現在22件の治験が登録されています。
健康な男性対象【6/23(日)入院開始】8泊9日+通院13回
| 問い合わせ番号 | 5591 |
|---|---|
| 実施地区 | 大阪市淀川区 |
| 説明 | 健康な日本人男性(28歳から50歳まで)を対象とした8泊9日の宿泊と通院13回の治験です。 実施医療機関:大阪府大阪市 入院:2024年6月23日(日)~7月1日(月) 通院:13回 事前検診1回目:5月27日(月)、5月30日(木)、6月6日(木)、6月10日(月) ※1日お選びください |
| ご協力いただける方 | ・28歳~50歳 健康な日本人(祖父母まで)男性 ・BMIが18.5~29.9 ・体重50㎏以上99.9kg以下 ※その他の条件によりご参加頂けない場合があります |
| 募集期限 | 2024年06月10日 |
健康な男性対象【5/30(木)入院開始】8泊9日+通院13回
| 問い合わせ番号 | 5582 |
|---|---|
| 実施地区 | 大阪市淀川区 |
| 説明 | 健康な日本人男性(28歳から50歳まで)を対象とした8泊9日の宿泊と通院13回の治験です。 実施医療機関:大阪府大阪市 入院:2024年5月30日(木)~6月7日(金) 通院:13回 事前検診1回目:5月7日(火)、5月10日(金)、5月15日(水)、5月17日(金) ※1日お選びください |
| ご協力いただける方 | ・28歳~50歳 健康な日本人(祖父母まで)男性 ・BMIが18.5~29.9 ・体重50㎏以上99.9kg以下 ※その他の条件によりご参加頂けない場合があります |
| 募集期限 | 2024年05月17日 |
【女性対象】発毛剤のお薬モニター
| 問い合わせ番号 | 5376 |
|---|---|
| 実施地区 | 大阪府吹田市 東京都新宿区 |
| 説明 | 毛量が減ってきた・・・・ ボリューム感やふわっと感が減った・・・・ 頭部の分け目の地肌が見えやすくなってきた・・・ 上記のような頭髪が気になり始めた女性の方を対象としたお薬モニターです。 一定の基準を満たす方を対象に、塗り薬タイプのお薬を、 約半年間使用していただいた際の効果と安全性について確認します。 参加期間:約7か月間(28週間) 通院内容:28週間の間に、4週間間隔で計8~9回通院していただきます 実施医療機関:大阪府吹田市 東京都新宿区 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢35歳以上75歳以下の女性 ・頭髪に関して、以下の症状に少なくとも1つ以上該当する方 *毛量が減ったと感じる。 *ボリューム感・ふわっと感が減ったと感じる。 *分け目等、地肌が見えやすくなったと感じる。 ・閉経しているまたは、月経周期が安定している方 (閉経直前で月経周期が不安定な方はご参加いただけません) ※その他の条件により、ご参加頂けない場合があります <ご参加可能な頭髪状態の目安> 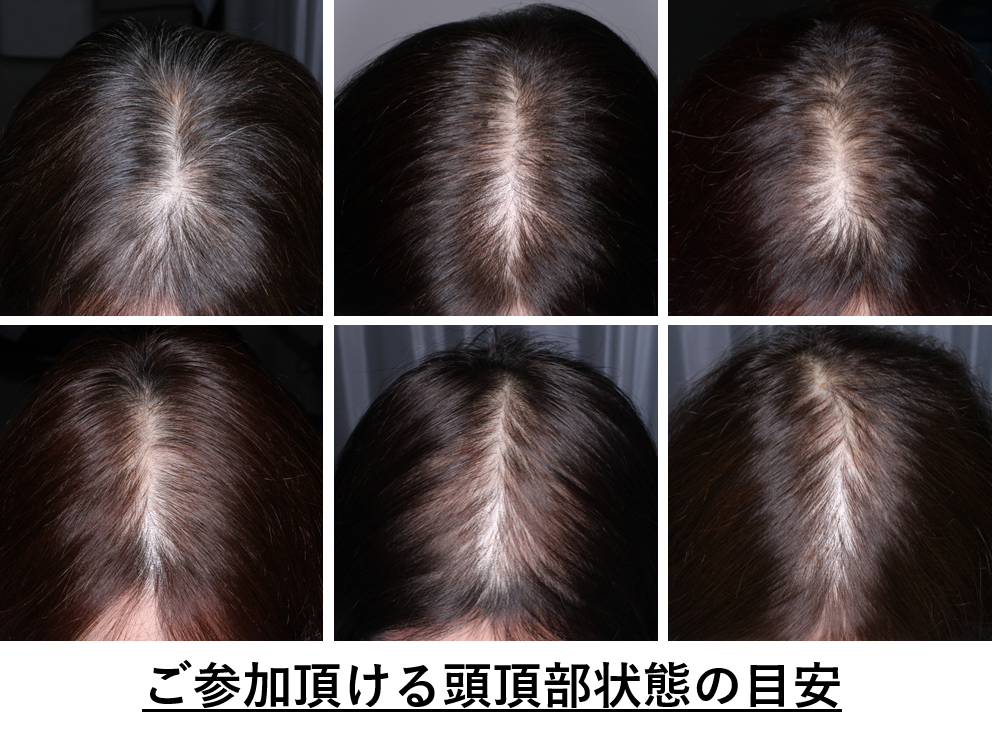 |
| 募集期限 | 2024年05月01日 |
【女性対象】発毛剤のお薬モニター(東京)
| 問い合わせ番号 | 5372 |
|---|---|
| 実施地区 | 東京都新宿区 |
| 説明 | 毛量が減ってきた・・・・ ボリューム感やふわっと感が減った・・・・ 頭部の分け目の地肌が見えやすくなってきた・・・ 上記のような頭髪が気になり始めた女性の方を対象としたお薬モニターです。 一定の基準を満たす方を対象に、塗り薬タイプのお薬を、 約半年間使用していただいた際の効果と安全性について確認します。 参加期間:約7か月間(28週間) 通院内容:28週間の間に、4週間間隔で計8~9回通院していただきます 実施医療機関:東京都新宿区 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢35歳以上75歳以下の女性 ・頭髪に関して、以下の症状に少なくとも1つ以上該当する方 *毛量が減ったと感じる。 *ボリューム感・ふわっと感が減ったと感じる。 *分け目等、地肌が見えやすくなったと感じる。 ・閉経しているまたは、月経周期が安定している方 (閉経直前で月経周期が不安定な方はご参加いただけません) ※その他の条件により、ご参加頂けない場合があります <ご参加可能な頭髪状態の目安>  |
| 募集期限 |
糖尿病の方を対象とした宿泊治験モニター(大阪)
| 問い合わせ番号 | 5597 |
|---|---|
| 実施地区 | 大阪府吹田市 |
| 説明 | BMIが高め(25.0以上)の糖尿病の方を対象とした宿泊治験モニターです。 現在開発中の注射タイプの治験薬を週1回の頻度で24週間投与した際の効果と安全性について確認します。 参加期間:約32週間 通院内容:説明会+26回通院+1泊2日の入院4回+3泊4日の入院2回 実施医療機関:大阪府吹田市 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上65歳以下男性または閉経後の女性。 ・現在糖尿病治療薬を服用していない、または経口タイプの治療薬を1剤使用中の方。 ・HbA1cが6.5%~8.5%の方。但し、現在治療中の方は、4週間の服薬中止後のHbA1cが6.5%~8.5%の方。 ・BMIが25.0以上39.9以下の方。BMI=体重(kg)÷身長(m)÷身長(m) ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
【足の潰瘍でお悩みの方】包括性高度慢性下肢虚血患者さんを対象としたお薬モニター(関西)
| 問い合わせ番号 | -572 |
|---|---|
| 実施地区 | 兵庫県西宮市 |
| 説明 | 包括的高度慢性下肢虚血(CLTI)とは 下肢の動脈硬化が進行すると足先への血管を介した栄養補給が不十分になる結果、靴擦れなどで足に生じた傷が治りにくくなります。 動脈硬化が進行する背景は様々ですが、動脈硬化が更に進行し、足先への血流がほとんどなくなってしまうと、 足先の皮膚や骨などの細胞組織が死んでしまい、潰瘍や壊疽(壊疽)が生じるリスクが高まります。 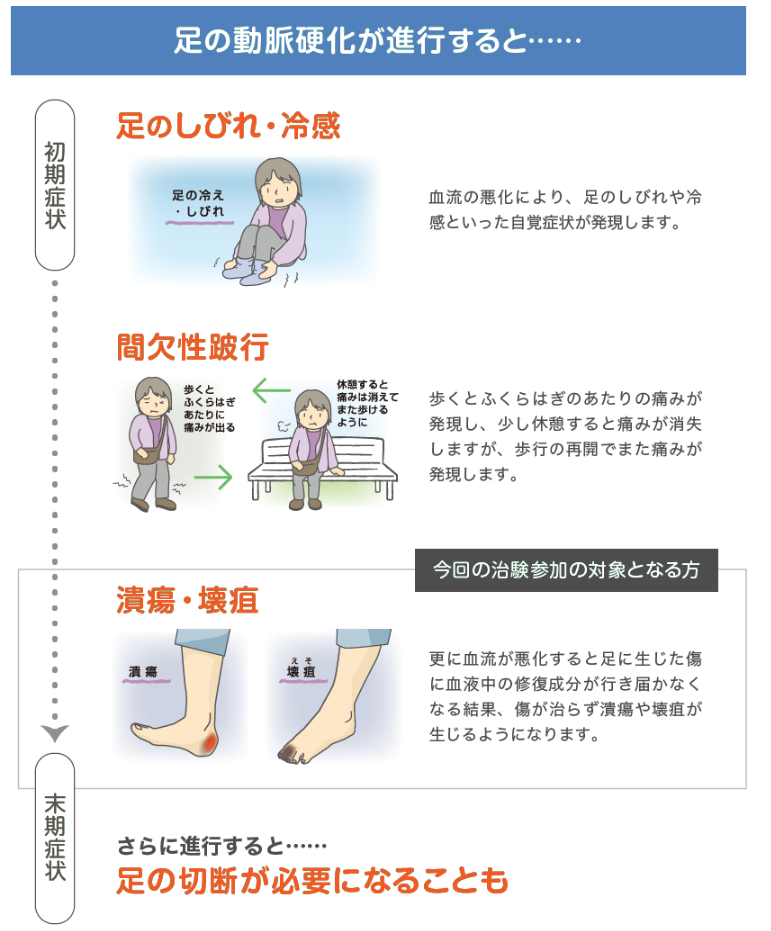 本治験では、現在足潰瘍が認められているCLTI患者さんを対象に開発中の新しいお薬を投与した際の効果と安全性について確認します。 参加期間:約1年間 通院内容:スクリーニング検査で基準を満たした方を対象に、約2週間の入院とその後5回通院していただきます。 実施医療機関:兵庫県西宮市 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢:20歳以上85歳以下 ・閉塞性動脈硬化症またはバージャー病と診断されている方 ・現在足潰瘍が認められている方 ※その他の条件によりご参加いただけない場合があります |
| 募集期限 |
ドライアイの方を対象としたお薬モニター(東京)
| 問い合わせ番号 | 5588 |
|---|---|
| 実施地区 | 東京都新宿区 |
| 説明 | ドライアイの方を対象としたお薬モニターです。 眼の乾燥感が一定の基準を満たす方を対象に開発中の点眼薬を8週間使用いただいた際の効果と安全性について確認いたします。 参加期間:約12週間 通院内容:説明会+5回通院 実施医療機関:東京都新宿区 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上75歳以下(男女不問) ・ドライアイの症状が両眼ともに6か月以上継続している方 ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
ドライアイの方を対象としたお薬モニター(大阪)
| 問い合わせ番号 | 5587 |
|---|---|
| 実施地区 | 大阪府吹田市 |
| 説明 | ドライアイの方を対象としたお薬モニターです。 眼の乾燥感が一定の基準を満たす方を対象に開発中の点眼薬を8週間使用いただいた際の効果と安全性について確認いたします。 参加期間:約12週間 通院内容:説明会+5回通院 実施医療機関:大阪府吹田市 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上75歳以下(男女不問) ・ドライアイの症状が両眼ともに6か月以上継続している方 ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
糖尿病の方対象お薬モニター(大阪)
| 問い合わせ番号 | 5466 |
|---|---|
| 実施地区 | 大阪府吹田市 |
| 説明 | 糖尿病の方を対象としたお薬モニター(治験)です。 本モニター(治験)では治験薬(飲み薬)を1日1回、約52週間服薬した際の効果と安全性について確認します。 参加期間:約58週間 通院内容:説明会+14~15回通院 実施医療機関:大阪府吹田市 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上75歳以下(男女不問) ・糖尿病の治療状況が未治療または経口剤1剤で治療中の方 ・HbA1cが7.0%以上10.5%以下の方 ・BMIが23以上の方≪BMI=体重(㎏)÷身長(m)÷身長(m)≫ ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
糖尿病の方対象お薬モニター(東京)
| 問い合わせ番号 | 5478 |
|---|---|
| 実施地区 | 東京都新宿区 |
| 説明 | 糖尿病のお薬を使用していない糖尿病の方を対象としたお薬モニター(治験)です。 本モニター(治験)では治験薬(飲み薬)を1日1回、約52週間服薬した際の効果と安全性について確認します。 参加期間:約58週間 通院内容:説明会+約14~15回通院 実施医療機関:東京都新宿区 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上75歳以下(男女不問) ・糖尿病の治療状況が未治療または経口剤1剤で治療中の方 ・HbA1cが7.0%以上10.5%以下の方 ・BMIが23以上の方≪BMI=体重(㎏)÷身長(m)÷身長(m)≫ ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
高血圧症の方を対象としたお薬モニター(大阪)
| 問い合わせ番号 | 5552 |
|---|---|
| 実施地区 | 大阪府吹田市 |
| 説明 | 高血圧症の方を対象としたお薬モニターです。 血圧が一定の基準を満たす方を対象に開発中のお薬を12週間~56週間服用いただいた際の効果と安全性について確認いたします。 参加期間:約13週間~60週間 通院内容:説明会+10~18回通院 実施医療機関:大阪府吹田市 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上75歳以下(男女不問) <降圧剤を使用していない方> ・上の血圧(収縮期血圧)が150mmHg以上の方 <降圧剤を使用中の方> ・お薬の治療を中止した場合に、上の血圧が150mmHg以上であることが予想される方 ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
高血圧症の方を対象としたお薬モニター(東京)
| 問い合わせ番号 | 5572 |
|---|---|
| 実施地区 | 東京都新宿区 |
| 説明 | 高血圧症の方を対象としたお薬モニターです。 血圧が一定の基準を満たす方を対象に開発中のお薬を12週間~56週間服用いただいた際の効果と安全性について確認いたします。 参加期間:約13週間~60週間 通院内容:説明会+10~18回通院 実施医療機関:東京都新宿区 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上75歳以下(男女不問) <降圧剤を使用していない方> ・上の血圧(収縮期血圧)が150mmHg以上の方 <降圧剤を使用中の方> ・お薬の治療を中止した場合に、上の血圧が150mmHg以上であることが予想される方 ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
肥満症の方を対象としたお薬モニター(東京)
| 問い合わせ番号 | 5510 |
|---|---|
| 実施地区 | 東京都新宿区 |
| 説明 | 肥満症の方を対象としたお薬モニターです。 一定の基準を満たす肥満の方を対象に開発中のお薬を36週間使用いただいた際の体重減少効果と安全性について確認いたします。 参加期間:約42週間 通院内容:説明会+12回通院 実施医療機関:東京都新宿区 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上(男女不問)。但し、女性の場合は閉経している方に限る ・BMI 27.0以上の方 BMI=体重(kg)÷身長(m)÷身長(m) ・BMIが30.0未満の方は、脂質異常症(高脂血症)または高血圧症のいずれかを合併している方 ・糖尿病を合併していない方 ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
肥満症の方を対象としたお薬モニター(大阪)
| 問い合わせ番号 | 5515 |
|---|---|
| 実施地区 | 大阪府吹田市 |
| 説明 | 肥満症の方を対象としたお薬モニターです。 一定の基準を満たす肥満の方を対象に開発中のお薬を36週間使用いただいた際の体重減少効果と安全性について確認いたします。 参加期間:約42週間 通院内容:説明会+12回通院 実施医療機関:大阪府吹田市 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上(男女不問)。但し女性の場合は閉経している方に限る ・BMI 27.0以上の方 BMI=体重(kg)÷身長(m)÷身長(m) ・BMIが30.0未満の方は、脂質異常症(高脂血症)または高血圧症のいずれかを合併している方 ・糖尿病を合併していない方 ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
【50歳以上の方対象】風邪症状発現時の鼻汁採取モニター(大阪)
| 問い合わせ番号 | 5527 |
|---|---|
| 実施地区 | 大阪市淀川区 |
| 説明 | 風邪症状発現時の鼻粘膜粘液、鼻汁、唾液を採取していただくモニターです。 所要時間約1時間、1日で終了のモニターです! 参加期間:1日 所要時間:約90分 通院内容:風邪症状発現後72時間以内に指定の医療機関に来院いただきます。 実施医療機関:大阪市淀川区 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢50歳以上(男女不問) ・風邪症状発現から72時間以内に指定の医療機関(大阪市淀川区)に来院が可能な方 |
| 募集期限 |
【手足のしびれや痛みのある方】糖尿病性神経障害の方を対象としたお薬モニター(大阪)
| 問い合わせ番号 | 5467 |
|---|---|
| 実施地区 | 大阪府吹田市 |
| 説明 | 糖尿病性神経障害性疼痛の方を対象としたお薬モニターです。 【糖尿病性神経障害とは】 糖分(グルコース)は、ヒトが生きていく上で欠かせない栄養素ですが、糖分の過剰な供給により血糖値が高い状態が長年にわたり継続すると手先や足先などの末梢神経に障害を引き起こします。障害がおこり手先や足先にしびれや痛みが継続的に発現し、高血糖(糖尿病)が原因で起こされている状態が糖尿病性神経障害です。 糖尿病性神経障害の特徴として、左右両方の手先や足先に同程度の症状が発現することが挙げられます。 参加期間:約32週間 通院内容:説明会+約21回通院 実施医療機関:大阪府吹田市 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上75歳以下(男女不問) ・糖尿病と診断されており、手先や足先に一定の基準以上の痛みやしびれが継続して認められる方 ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
【手足のしびれや痛みのある方】糖尿病性神経障害の方を対象としたお薬モニター(東京)
| 問い合わせ番号 | 5418 |
|---|---|
| 実施地区 | 東京都新宿区 |
| 説明 | 糖尿病性神経障害性疼痛の方を対象としたお薬モニターです。 【糖尿病性神経障害とは】 糖分(グルコース)は、ヒトが生きていく上で欠かせない栄養素ですが、糖分の過剰な供給により血糖値が高い状態が長年にわたり継続すると手先や足先などの末梢神経に障害を引き起こします。障害がおこり手先や足先にしびれや痛みが継続的に発現し、高血糖(糖尿病)が原因で起こされている状態が糖尿病性神経障害です。 糖尿病性神経障害の特徴として、左右両方の手先や足先に同程度の症状が発現することが挙げられます。 参加期間:約32週間 通院内容:説明会+約21回通院 実施医療機関:東京都新宿区 |
| ご協力いただける方 | 以下の全てに該当する方 ・年齢18歳以上75歳以下(男女不問) ・糖尿病と診断されており、手先や足先に一定の基準以上の痛みやしびれが継続して認められる方 ※その他の条件により、ご参加頂けない場合があります |
| 募集期限 |
【先行予約受付中】化粧品モニター試験にご協力ください
| 問い合わせ番号 | -428 |
|---|---|
| 実施地区 | 東京都23区内 大阪府大阪市内 |
| 説明 | 化粧品モニター試験の先行募集です。 目尻のシワが気になる方に、指定の化粧水、フェイスクリームなどを約4~8週間使用いただいた際の効果を確認するモニターです。 インクロムボランティアセンターでは、毎年秋~冬にかけて多くの化粧品モニター試験を実施しており、 2022年度は20試験に延べ400名近くの方にご協力いただきました。 今年も秋以降に多くの化粧品モニター試験を実施予定です。 実施の時期が近づいて参りましたら、ご希望いただいた方に優先的にご案内させていただきます。 実施地域;東京都23区内 大阪府大阪市内 化粧品モニター実施事例 ①乾燥肌の方を対象とした保湿化粧水モニター 概要:乾燥肌の自覚がある方を対象に保湿化粧水を4週間使用いただいた際の効果について確認します。 実施地域;大阪府大阪市 通院回数:3回(スクリーニング検査 化粧水開始時 開始4週後) モニター協力費:13,000円(最後までご協力頂いた場合) ②目尻シワグレード1~3の方を対象とした美容液モニター 概要:目尻のシワグレードが1~3の方を対象に美容液を12週間使用いただいた際の効果について確認します。 ※シワグレードの判定目安はこちら 実施地域;東京都渋谷区 通院回数:4回(スクリーニング検査 美容液開始時 開始6週後 開始12週後) モニター協力費:33,000円(最後までご協力頂いた場合) |
| ご協力いただける方 | 18~59歳の日本人女性 試験内容によって様々な参加条件がございます。 ご案内する試験毎に異なりますので、都度ご確認ください。 |
| 募集期限 | 2024年12月01日 |
来院1回のみ!!約2時間で終了する採血モニター
| 問い合わせ番号 | -411 |
|---|---|
| 実施地区 | 東京都新宿区 大阪市淀川区 大阪府吹田市 |
| 説明 | たった1回の通院のみで終了する採血モニター試験です。 協力費(負担軽減費):10,000円 お薬の投与などもなく、研究用の血液検体を提供いただく内容なので、献血のイメージでご参加下さい。 ※2022年は100名以上の実施実績があり、今後も定期的に実施する予定です。 今のうちに登録を済ませておけば、実際に案件が入った際には順次優先的にご案内します(^^) |
| ご協力いただける方 | ・18歳~65歳の健康な日本人(祖父母まで)の方 ※ご年齢によってご案内できる試験数に差があります。 |
| 募集期限 | 2050年05月18日 |
【70歳以上の健康な方対象】アルツハイマー型認知症発症予防のお薬モニター(大阪)
| 問い合わせ番号 | 4738 |
|---|---|
| 実施地区 | 大阪市淀川区 |
| 説明 | アルツハイマー型認知症患者では、脳内にアミロイドベータと呼ばれるタンパク質が多く蓄積されていることが報告されており、現在認知機能が正常な方でも、脳内にこのたんぱく質が多く蓄積されている場合、将来的にアルツハイマー型認知症を発症するリスクが高いと考えられております。 この治験では、現在認知機能が正常な方を対象にスクリーニング検査を行いアルツハイマー型認知症を発症するリスクが高いと判定された方を対象に、4年間にわたって新しいお薬の治療効果について確認します。 試験開始時期:2021年2月 参加期間:スクリーニング期間 約90日間 治療期間 約4年間 通院回数:スクリーニング期間 通院5回 治療期間 62回~86回 実施施設:大阪市淀川区 |
| ご協力いただける方 | ・70歳以上80歳以下の方で、認知機能が正常な方(男女不問) ・スクリーニング検査の結果、将来的にアルツハイマー型認知症を発症するリスクが高いと判定された方 ・対面、電話、メールなどで、週1回以上コミュニケーションをとっているパートナーがいる方 |
| 募集期限 | 2024年08月01日 |
骨髄線維症でお悩みの方を対象のお薬モニター
| 問い合わせ番号 | -421 |
|---|---|
| 実施地区 | 北海道、岩手、福島、埼玉、東京、山梨、静岡、石川、愛知、大阪、兵庫、岐阜、三重、岡山、福岡、宮崎 |
| 説明 | 本治験の目的 本治験は、骨髄線維症の患者さんを対象に、 治験薬を服用した際の有効性と安全性を評価することを目的としています。 ※お電話にて詳細内容をご説明いたします。 治験薬について 本治験で使用する治験薬は飲み薬です。 がん細胞の増殖に重要なタンパク質(アポトーシス抑制性BCL-2 ファミリータンパク質)を阻害し、脾臓の腫れを抑える効果が期待されます。 実施期間 2023年9月まで |
| ご協力いただける方 | ・18歳以上の方 ・骨髄線維症と診断されている方 ・骨髄線維症でお悩みの方 ・現在の治療で症状が改善しない方 |
| 募集期限 |
高血圧を治療中で血圧が下がらずお悩みの方へ
| 問い合わせ番号 | -292 |
|---|---|
| 実施地区 | [北海道]北海道 [東北]山形県、宮城県 [関東]東京都、千葉県、神奈川県、栃木県 [東海]三重県 [北陸]石川県 [近畿]大阪府、兵庫県 [中国]広島県 [四国]高知県 [九州]福岡県、宮崎県、鹿児島県、沖縄県 ※試験の状況により記載エリアは変動します。 |
| 説明 | 【試験概要】 高血圧の治療をしていても血圧が下がりにくい方を対象とした、腎デナベーション術の試験です。 ■腎デナベーション術:腎臓に血液を送る血管の周りの交感神経の機能を超音波で抑制・遮断することにより、血圧を下げることが期待されている治療法です。 ■参加期間・通院回数 参加いただいた場合、約5年間ご協力いただく長期試験です。 通院回数は22回程度を見越しています。 ※2年目以降は1年に1回のペースで通院していただきます。 ■手術後の来院回数 手術後の経過観察期間としては、5年間で15回の来院を予定しております。 【実施内容】 ※来院日程は医療機関担当者と調整していただきます。 ■事前調査・事前検査 身体検査、採血、採尿、病院や自宅での血圧測定、日誌、24時間血圧測定(※)など 事前調査・検査では計2回の通院を予定しています。 ※24時間血圧測定:30分に1回自動で血圧を測定する携帯式の血圧計を約1日使用いただきます。測定開始の翌日に改めて来院いただきデータを確認いたします。治験参加期間では合計5回ほどご協力いただきます。 ■手術入院・検査 毎日の日誌回答と、これまでにお受けいただいた検査のいくつかを実施します。 手術後半年間は1ヵ月に1回の頻度で通院・検査が必要となり、この期間に2回24時間血圧測定が行われます。 それ以降は3ヵ月ごとの来院が2回、1年ごとの来院が4回予定されています。 ■手術後の来院回数 手術後の経過観察期間としては、5年間で15回の来院を予定しております。 ※本治験の特徴 腎デナベーション術を受けていただく群と受けていただかない群に分かれて参加いただきます。 腎デナベーション術を受けない群に参加した方は手術日には模擬的な手術を受けていただきます。 手術を受けていただいてから半年後、どちらの群に参加されているかの情報が開示され、腎デナベーション術を受けていなかった方には、改めて腎デナベーション術を受けるかどうかをお選びいただけます。 ご希望いただいた場合は改めていくつかの検査を実施し、手術を受けられる条件に該当していましたら新ためて入院日程を調整させていただきます。 |
| ご協力いただける方 | 以下の参加条件全てに該当する方 ・性別: 男女 ・年齢範囲: 20〜75歳 ・高血圧の診断がある方 ・3ヵ月以上前から、血圧を下げるためのお薬を使用している方 ・4週以上前から、血圧を下げるためのお薬を2種類以上使用している方 ・4週間以上前から、血圧を下げるためのお薬の量が変動していない方 ・医療機関で測定した血圧が、収縮期140~180 mmHg未満であり、拡張期90 ~110 mmHg未満である方 |
| 募集期限 |
過去342件の治験が登録されていました。
【お肌がきれいな60代女性を対象】肌測定モニターのご案内
| 問い合わせ番号 | -101 |
|---|---|
| 実施地区 | |
| 説明 | 今回はご家族やご友人、職場の方などから最近、「お肌がきれいですね」など、最近周りの方から、ご自身のお肌を褒められることや羨ましがられることなどのご経験はございませんでしょうか、今回はそのようなお肌のきれいな60代女性を対象の肌測定モニターの募集です。 自己申告で美肌と認識されている方とそうではない方の顔の皮膚状態を、3種類の測定機器を用いて顔の正面、左右、全顔の3D写真を撮影と水分量、蒸発量、粘弾性、皮膚量を測定します。(当日の拘束時間:約170分) 【通院スケジュール】 来社11/12(木) 実施時間①9:00 ②9:45 ③13:00 ④13:45 ⑤14:30 ⑥15:15 ※①~⑥の受付時間帯よりお一つお選び下さい。 所要時間:約170分 ※機器による肌本来の水分量等の測定になりますので、当日の測定前にメイク落としと洗顔フォームで洗顔頂きます。 【募集定員】 5名 |
| ご協力いただける方 | ・60代の女性 ・1ヶ月以内にご家族やご友人、職場の方などの周りから「美肌」と言われた経験がある方 ・宣伝広告媒体や研究成果の公開における匿名での写真使用に同意いただける方 ※全顔写真もしくは一部拡大写真のいずれかの写真になりますが、目隠し等匿名化を行います。 ・現在何らかの疾患で通院治療をされていない方 ・額、両こめかみ、両頬上部、両頬、両頬下部、フェイスラインの 測定部位に外傷 ・傷跡 ・ 瘢痕 のない方 ・試験当日の測定前に化粧を落としていただくことに協力いただける方 ・試験当日にコロナ対策として、手指のアルコール消毒、体温測定に協力いただける方 ・大阪市中央区の施設まで来社できる方 |
| 募集期限 | 2020年11月12日 |
【医療モニター】70歳以上の高齢者を対象の採血試験モニター(関西
| 問い合わせ番号 | 4845 |
|---|---|
| 実施地区 | |
| 説明 | 70歳以上の高齢者を対象に、指定された医療機関へ通院いただき、採血にご協力いただき、医療モニターのご案内です。 所要時間30分程度です。 参加開始時期:2020年9月 参加期間:1日 内容:通院1回 実施場所:京都市内 |
| ご協力いただける方 | ・関西在住 ・70歳以上の男女 ・治療を要する疾患がない方 ・指定する医療機関に通院が可能な方 |
| 募集期限 | 2020年09月11日 |
【美容モニター】拭き取りシートによるにきび改善効果の評価試験(関東)
| 問い合わせ番号 | 4834 |
|---|---|
| 実施地区 | |
| 説明 | にきび症状でお悩みの男女を対象に、拭き取りシートによるにきびの予防効果を評価する試験のご案内です。モニター期間中に朝と晩の1日2回、指定する拭き取りシートで顔をふき取っていただきます。 来所時には、皮膚の水分量測定、ニキビ患部の写真撮影、皮膚科医により診察等に協力いただきます。 参加開始時期:2020年9月 参加期間:3ヵ月 内容:通院4回 |
| ご協力いただける方 | ・関東在住の方 ・20歳から39歳までの日本人男性と女性 ・左右いづれかの片顔に、炎症性皮疹(にきび)が6個以上20個以下の方 |
| 募集期限 | 2020年08月31日 |
【美容モニター】抗シワ化粧品モニター(関東)
| 問い合わせ番号 | 4812 |
|---|---|
| 実施地区 | |
| 説明 | 目尻のシワが気になる方を対象に2種類のモニター用化粧品(洗顔剤)のいずれかを4週間使用していただきます。 モニター期間中は、UV製品とメイク用品は両顔とも使用できます。 参加開始時期:2020年7月 参加期間:2ヵ月間 内容:通院2回 |
| ご協力いただける方 | ・関東在住 ・35歳~59歳の女性の方で、目尻のシワグレード2と3に該当する方 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2020年07月31日 |
【サプリメントモニター】必須アミノ酸サプリのモニター(関東)
| 問い合わせ番号 | 4822 |
|---|---|
| 実施地区 | |
| 説明 | 健康な35歳から59歳の方に約1ヵ月間、指定するサプリメントを通常の摂取量の5倍量を摂取いただきます。朝昼晩の各1回当たりの摂取粒数が10粒となり、試験品摂取群とプラセボ群に分かれて参加いただきます。 来院当日は、採血・採尿、血圧・体重測定、アンケートの回答にご協力いただきます。 参加開始時期:2020年8月 参加期間:2ヵ月間 内容:通院:2回 |
| ご協力いただける方 | ・関東在住 ・モニターの期間中に、新たにサプリメントや医薬品の摂取を開始する予定のない方 ・男女不問30歳~59歳以下 |
| 募集期限 | 2020年08月26日 |
【美容モニター】小鼻の黒ずみが気になる方を対象化粧品モニター(関東)
| 問い合わせ番号 | 4835 |
|---|---|
| 実施地区 | |
| 説明 | 目尻のシワが気になり、特に小鼻の黒ずみが気になる方を対象に既に市販されている本モニターの指定する洗顔剤と日頃ご使用の洗顔剤をお使いいただき、抗シワ効果や毛穴をきれいにする効果を比較する内容です。 試験期間中は日頃お使いのスキンケア製品をお使いいただけます。 参加開始時期:2020年9月 参加期間:2ヵ月間 内容:通院2回 |
| ご協力いただける方 | ・関東在住 ・小鼻の黒ずみが特に気になる方 ・35歳~59歳の女性の方で、シワグレード分類が特定のグレードに該当する方 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2020年09月16日 |
【新型インフルエンザ治療薬】17泊18日の長期入院試験(関西)
| 問い合わせ番号 | 2819 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、将来の新型インフルエンザの大流行(パンデミック)に備えるために、開発される抗ウイルス薬です。 近年、従来ヒトへの感染がみられなかった鳥インフルエンザなどの毒性の強い新たなインフルエンザが出現し、ヒトへの感染も相次いで確認されております。そのような状況で、新たなインフルエンザ感染症治療薬の開発が望まれるようになり、今回開発に至りました。 試験実施時期:2011年11月 内容:17泊18日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年3月24日に「アビガン錠200mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から39歳までの健康な日本人男性 体重が55㎏以上 BMI;18.5~30.0 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2011年11月18日 |
【サプリメントモニター】運動不足の方対象の酵素サプリメントのモニター試験(関東)
| 問い合わせ番号 | 4652 |
|---|---|
| 実施地区 | |
| 説明 | 日頃から定期的に激しい運動をされていない運動不足の方が対象の酵素サプリメントのモニター試験のご案内です。 ~~通院3回のみ。今話題の酵素サプリメントのモニターです。~~ ~~8週間服用時の代謝機能の変化を調べる試験です。~~ 酵素サプリメントを約8週間服用していただき、代謝機能の変化を評価します。尚、試験期間中は、毎日簡単な日誌を記入していただきメール添付による提出が必要となります。 参加開始時期:2019年11月 参加期間:3ヵ月間 内容:通院:3回 |
| ご協力いただける方 | ・関東在住 ・日頃から定期的に激しい運動をしておらず、運動不足の自覚がある方 ・男女不問30歳~59歳以下 ・BMIが30未満の方 |
| 募集期限 | 2019年11月17日 |
【美容モニター】顔のたるみが気になる女性の方対象の化粧品モニター(関東)
| 問い合わせ番号 | 4675 |
|---|---|
| 実施地区 | |
| 説明 | フェイスラインやほうれい線など顔のたるみが気になる方を対象にファンデーションを使用し小顔効果を検証します。 モニター用のファンデーションとスポンジ、簡単なマッサージを併用し2週間使用いただくグループと、ご自身のファンデーションを通常通り使用いただくグループに分かれます。どちらのグループになるかはランダムで決まりますので、お選びいただくことはできません。 参加開始時期:2019年12月 参加期間:1ヶ月間 内容:通院2回 |
| ご協力いただける方 | ・関東在住 ・30歳~69歳の女性 ・フェイスラインやほうれい線などの顔のたるみが気になる方 ・日頃からファンデーションを使用している方(形状は不問) |
| 募集期限 | 2019年12月06日 |
【健康食品モニター】果汁飲料の過剰摂取を検証する食品モニター(関東)
| 問い合わせ番号 | 4604 |
|---|---|
| 実施地区 | |
| 説明 | 健康食品メーカーが発売する果汁ジュースを4週間摂取いただき、血圧・採血・採尿を実施しデータを評価する食品モニター試験のご案内です。 参加開始時期:2019年7月 参加期間:2ヵ月間 内容:通院2回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・20歳~65歳以下の男女 ・BMIが23以上30未満 |
| 募集期限 | 2019年07月25日 |
【サプリメントモニター】日焼け止め、シミ予防を望む女性向けモニター試験(関東)
| 問い合わせ番号 | 4558 |
|---|---|
| 実施地区 | |
| 説明 | 日焼けを気にしている女性を対象に、既に市販されている太陽から肌を守るサプリメントをご使用いただき、モニターにご協力いただく内容です。尚、サプリメントは無料で提供致します。 参加開始時期:2019年5月 参加期間:4ヵ月間 内容:通院3回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・日焼けを気にしている方 ・日光に当たると赤くなるより、黒くなりやすい方 ・35歳~59歳の女性の方 |
| 募集期限 | 2019年05月10日 |
【美容モニター】ほうれい線やフェイスラインのたるみが気になる方対象(関東)
| 問い合わせ番号 | 4482 |
|---|---|
| 実施地区 | |
| 説明 | 最近、ほうれい線やフェイスラインのたるみが気になる方対象に、既に市販されている化粧水を4週間ご使用く化粧品モニターのご案内です。 治験開始時期:2019年3月 参加期間;2ヵ月 内容:通院2回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・顔が乾燥肌の方 (Tゾーンのみ脂性肌でその他が乾燥肌の方も可) ・35歳~59歳の女性の方で、シワグレード分類が2~3の方 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2019年03月12日 |
【健康食品モニター】リラックス効果が期待できる健康食品モニター試験(関東)
| 問い合わせ番号 | 4674 |
|---|---|
| 実施地区 | |
| 説明 | 「普段の生活で不安を感じている方」を対象としたリラックス効果が期待できる乳酸菌含有の健康食品モニターでず。 約2か月間、試験食品を摂取して頂き、精神状態の安定を検証する内容です。 参加開始時期:2019年1月 参加期間:2ヶ月間 内容:通院2回 |
| ご協力いただける方 | ・関東在住の方 ・普段の生活で不安を感じている方 ・男女不問、年齢20歳から60歳までの日本国籍を有する方 ・身分証明書をお持ちの方 ・スマートフォンをお持ちの方(※iOS、Andoroidに限ります) |
| 募集期限 | 2019年03月27日 |
【美容モニター】抗シワ化粧品モニター(関東)
| 問い合わせ番号 | 4693 |
|---|---|
| 実施地区 | |
| 説明 | 目尻のシワが気になる方を対象に3種類のモニター用化粧品(洗顔料・クレンジング・化粧水)のいずれかを4週間使用していただきます。 指定する化粧品の評価の為来所時に機器による撮影および参加期間中は日誌を記入いただき定期的にメール添付により提出がございます。 参加開始時期:2020年2月 参加期間:2ヵ月間 内容:通院2回 |
| ご協力いただける方 | ・関東在住 ・35歳~59歳の女性の方で、シワグレード分類が特定のグレードに該当する方 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2020年02月01日 |
【糖尿病】インスリン製剤で治療中の患者対象の長期投与試験(関東)
| 問い合わせ番号 | 4098 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 試験開始時期:2017年8月 参加期間:最大40週間 内容:通院22回 実施施設:東京都新宿区 この治験で使用された治験薬は、2020年3月25日に「ソリクア配合注ソロスター」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病と診断されている方 試験開始の3ヵ月前からインスリン製剤を1日1回使用している方 |
| 募集期限 | 2018年03月27日 |
【糖尿病】インスリン製剤で治療中の患者対象の長期投与試験(関西)
| 問い合わせ番号 | 4099 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2017年8月 参加期間:最大40週間 内容:通院22回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2020年3月25日に「ソリクア配合注ソロスター」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病と診断されている方 試験開始の3ヵ月前からインスリン製剤を1日1回使用している方 |
| 募集期限 | 2017年11月14日 |
【糖尿病】3剤以下で治療中の方へ(関西)
| 問い合わせ番号 | 3783 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 現在糖尿病の内服薬治療(3剤まで)しているのにも関わらず血糖コントロールが不十分な方を対象に治験薬を追加で併用していただく治験です。 現在治療中の状態に追加で治験薬を服用していただく試験なので、悪化するリスクが低く、初めて参加される方にもおすすめです。 参加開始時期:2016年5月 参加期間:約7ヵ月間(29週間) 内容:通院10回程度 実施施設:大阪府淀川区 この治験で使用された治験薬は、2020年3月25日に「ソリクア配合注ソロスター」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で、以下の全ての条件に該当する方 ①1年以上前から2型糖尿病と診断されている方 ②3剤までの血糖降下薬で治療中でかつHbA1c7.5%以上10.0%以下の方 |
| 募集期限 | 2016年12月28日 |
【糖尿病】治療中の方でも参加できます(関東)
| 問い合わせ番号 | 3836 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 現在糖尿病の内服薬治療(3剤まで)しているのにも関わらず血糖コントロールが不十分な方を対象に治験薬を追加で併用していただく治験です。 現在治療中の状態に追加で治験薬を服用していただく試験なので、悪化するリスクが低く、初めて参加される方にもおすすめです。 参加開始時期:2016年5月 参加期間:約7ヵ月間(29週間) 内容:通院10回程度 実施施設:東京都新宿区 この治験で使用された治験薬は、2020年3月25日に「ソリクア配合注ソロスター」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で、以下の全ての条件に該当する方 ①1年以上前から2型糖尿病と診断されている方 ②3剤までの血糖降下薬で治療中でかつHbA1c7.5%以上9.5%以下の方 |
| 募集期限 | 2017年08月15日 |
【糖尿病】治療中の方でも参加できます(関西)
| 問い合わせ番号 | 3782 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 現在糖尿病の内服薬治療(3剤まで)しているのにも関わらず血糖コントロールが不十分な方を対象に治験薬を追加で併用していただく治験です。 現在治療中の状態に追加で治験薬を服用していただく試験なので、悪化するリスクが低く、初めて参加される方にもおすすめです。 試験開始時期:2016年5月 参加期間:約7ヵ月間(29週間) 内容:通院10回程度 実施施設:大阪府吹田市 この治験で使用された治験薬は、2020年3月25日に「ソリクア配合注ソロスター」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で、以下の全ての条件に該当する方 ①1年以上前から2型糖尿病と診断されている方 ②3剤までの血糖降下薬で治療中でかつHbA1c7.5%以上9.5%以下の方 |
| 募集期限 | 2017年09月27日 |
【スギ花粉症】重度の症状でお困りの方対象の通院試験(関東)
| 問い合わせ番号 | 4046 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 日本におけるスギ花粉症患者は増加の一途をたどり、4人に1人は花粉症であると言われております。 その中でも重度の花粉症は、仕事や日常生活に支障をきたす為、適切な治療が必要です。 既に多くの医薬品が開発され市販されておりますが、重度の患者さんにも満足がいくより効果の高い薬の開発に向けて日々研究されています。 インクロムボランティアセンターでは、2017年10月頃より重度のスギ花粉症患者を対象とした治験を実施予定です。 新しい治療にご興味をお持ちでまだボランティア登録されていない方は、この機会にぜひご登録ください。 ご登録いただけますと、試験の実施が確定後優先的にご案内させていただきます。 試験開始時期:2018年1月 参加期間:最大41週間 内容:9回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年12月11日に「ゾレア皮下注用75mg/ゾレア皮下注用150mg」として適応追加が承認されました。 |
| ご協力いただける方 | 年齢20以上(男女不問)で以下の条件にあてはまる方 ・過去2シーズン以上継続して病院やクリニックでの処方を受けてスギ花粉症の治療をされている方 ・過去2シーズン以上継続して点鼻ステロイド薬を処方され使用されている方 |
| 募集期限 | 2018年01月27日 |
【糖尿病】1剤まで治療中の方対象(関東)
| 問い合わせ番号 | 3610 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 試験開始時期:2015年5月 参加期間:約1年9か月 内容:通院18回 実施施設:東京都新宿区 この治験で使用された治験薬は、2018年9月21日に「トラディアンス配合錠AP/トラディアンス配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上73歳以下(男女不問)の方で、以下のいずれかの条件に該当する方 ①食事療法・運動療法のみで血糖コントロールを行っており ヘモグロビンA1c(HbA1c)が8.0%以上10.5%以下 ②糖尿病治療薬を1種類のみ服用しており ヘモグロビンA1c(HbA1c)が7.5%以上9.5%以下 |
| 募集期限 | 2016年03月27日 |
【糖尿病】1剤まで治療中の方対象(関西)
| 問い合わせ番号 | 3541 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2015年5月 参加期間:約1年9か月 内容:通院18回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2018年9月21日に「トラディアンス配合錠AP/トラディアンス配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上73歳以下(男女不問)の方で、以下のいずれかの条件に該当する方 ①食事療法・運動療法のみで血糖コントロールを行っており ヘモグロビンA1c(HbA1c)が8.0%以上10.5%以下 ②糖尿病治療薬を1種類のみ服用しており ヘモグロビンA1c(HbA1c)が7.5%以上9.5%以下 |
| 募集期限 | 2015年08月31日 |
【糖尿病】1剤まで治療中の方対象、長期投与試験(関東)
| 問い合わせ番号 | 3565 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2015年5月 参加期間:約1年9か月 内容:通院18回 実施施設:東京都新宿区 この治験で使用された治験薬は、2018年9月21日に「トラディアンス配合錠AP/トラディアンス配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上73歳以下(男女不問)の方で、以下のいずれかの条件に該当する方 ①食事療法・運動療法のみで血糖コントロールを行っており ヘモグロビンA1c(HbA1c)が8.0%以上10.5%以下 ②糖尿病治療薬を1種類のみ服用しており ヘモグロビンA1c(HbA1c)が7.5%以上9.5%以下 |
| 募集期限 | 2016年02月27日 |
【糖尿病】1剤まで治療中の方対象長期投与試験(関西)
| 問い合わせ番号 | 3543 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2015年5月 参加期間:約1年9か月 内容:通院18回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2018年9月21日に「トラディアンス配合錠AP/トラディアンス配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上73歳以下(男女不問)の方で、以下のいずれかの条件に該当する方 ①食事療法・運動療法のみで血糖コントロールを行っており ヘモグロビンA1c(HbA1c)が8.0%以上10.5%以下 ②糖尿病治療薬を1種類のみ服用しており ヘモグロビンA1c(HbA1c)が7.5%以上9.5%以下 |
| 募集期限 | 2016年01月31日 |
【糖尿病】1剤治療中でHbA1c7.5以上の方対象(関東)
| 問い合わせ番号 | 3566 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2015年6月 参加期間:約1年2か月 内容:通院24回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年1月20日に「ビクトーザ皮下注18mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上73歳以下(男女不問)の方で、以下の条件に該当する方 経口糖尿病治療薬を1種類のみ服用しており、 ヘモグロビンA1c(HbA1c)が7.5%以上10.0%以下 |
| 募集期限 | 2016年11月27日 |
【糖尿病】1剤治療中でHbA1c7.5以上の方対象(関西)
| 問い合わせ番号 | 3542 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2015年6月 参加期間:約1年2か月 内容:通院24回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年1月20日に「ビクトーザ皮下注18mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上73歳以下(男女不問)の方で、以下のいずれかの条件に該当する方 経口糖尿病治療薬を1種類のみ服用しており ヘモグロビンA1c(HbA1c)が7.5%以上10.0%以下 |
| 募集期限 | 2015年11月30日 |
【脂質異常症】1剤で治療中の方対象長期試験(関西)
| 問い合わせ番号 | 3557 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2016年5月 参加期間:約15ヶ月間 内容:通院10回程度 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年3月26日に「ロスーゼット配合錠LD/ロスーゼット配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で、以下の全ての条件に該当する方 ①試験開始4週間以上前から脂質低下薬を1種類服用している方 ②LDL-C(LDLコレステロール)値が120㎎/dL以上の方 |
| 募集期限 | 2016年10月31日 |
【脂質異常症】6月から開始 長期通院試験(関東)
| 問い合わせ番号 | 3560 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2015年6月 参加期間:約16ヵ月間(64週間) 内容:通院10回程度 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年3月26日に「ロスーゼット配合錠LD/ロスーゼット配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で、以下の全ての条件に該当する方 ①試験開始4週間以上前から脂質低下薬であるアトルバスタチン(リピトール)、エゼミチブ(ゼチーア)を服用している方 ②LDL-C(LDLコレステロール)値が120㎎/dL以上の方 |
| 募集期限 | 2016年10月31日 |
【脂質異常症】未治療もしくは1剤で治療中の方へ(関西)
| 問い合わせ番号 | 3761 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2016年5月 参加期間:約5ヶ月(最大6ヶ月) 内容:通院7回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年3月26日に「ロスーゼット配合錠LD/ロスーゼット配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上74歳以下(男女不問)の方で、以下のいずれか条件に該当する方 ①脂質異常症の治療をされていない方で、LDL-コレステロールが170以上の方 ②脂質異常症の治療中の方で、LDLコレステロールが140以上の方 |
| 募集期限 | 2016年09月11日 |
【末梢性神経障害性疼痛】2ヵ月間に8回の通院型試験(関東)
| 問い合わせ番号 | 2856 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 試験実施時期:2012年2月 参加期間:約8週間 内容:通院7回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年1月に「タリージェ®錠 2.5mg・5mg・10mg・15mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上 参加時に、1型もしくは2型糖尿病の方 参加時に、手足の指先に疼痛の症状がある方 |
| 募集期限 | 2012年12月15日 |
【末梢性神経障害性疼痛】2ヵ月間に8回の通院型試験(関西)
| 問い合わせ番号 | 2848 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験実施時期:2012年3月 参加期間:約8週間 内容:通院7回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年1月に「タリージェ®錠 2.5mg・5mg・10mg・15mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上 参加時に、1型もしくは2型糖尿病の方 参加時に、手足の指先に疼痛の症状がある方 |
| 募集期限 | 2012年12月15日 |
【高血圧症】血圧が高い患者を対象の入院試験と通院試験のご案内(関東)
| 問い合わせ番号 | 2971 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回は血圧が高い方を対象に実施する治験です。 50名に参加いただく通院のみの試験日程と2つの試験日程にわかれて実施致します。 会社の健康診断で血圧が高いと指摘を受けた方、ご応募ください。 お待ちしております。 試験実施時期:2012年8月 参加期間:12週間 内容:①5泊6日+通院10回 ②通院12回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上70歳以下の方 投与前の血圧測定で、収縮期血圧140mmHg以上180mmHg未満かつ拡張期血圧90mmHg以上110mmHg未満の範囲内である方 |
| 募集期限 | 2013年03月20日 |
【新型インフルエンザ治療薬】9泊10日+7泊8日の長期入院試験(関西)
| 問い合わせ番号 | 2821 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、将来の新型インフルエンザの大流行(パンデミック)に備えるために、開発される抗ウイルス薬です。 近年、鳥インフルエンザなどの毒性の強い新たなウイルスが出現し、ヒトへの感染も相次いで確認されております。そのような状況で、新たなインフルエンザ感染症治療薬の開発が望まれるようになり、今回開発に至りました。 試験実施時期:2011年10月 内容:9泊10日+7泊8日+通院1回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年3月24日に「アビガン錠200mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から39歳までの健康な日本人男性 体重が55㎏以上 BMI;18.5~30.0 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2011年10月18日 |
【高血圧症】1剤で治療中の患者対象の通院型試験(関東)
| 問い合わせ番号 | 3977 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 高血圧症の治療薬を1種類のみで服用されている患者が対象の通院型試験です。週末日程もありますので、お勤めの方も参加しやすいです。高血圧症で治療されている方、ご応募をお待ちしております。 試験実施時期:2016年11月 参加期間:17週間 内容:通院14回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年1月8日に「ミネブロR錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の高血圧症患者 治験薬投与前の血圧値が以下の基準の方 収縮期血圧140 mmHg以上180 mmHg未満かつ拡張期血圧80 mmHg以上110 mmHg未満 治験薬投与開始前4週間以上前から指定の降圧剤1種類を服用している方 |
| 募集期限 | 2016年12月15日 |
【高血圧症】1剤で治療中の患者対象の通院型試験(関西)
| 問い合わせ番号 | 3973 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 高血圧症の治療薬を1種類のみで服用されている患者が対象の通院型試験です。週末日程もありますので、お勤めの方も参加しやすいです。高血圧症で治療されている方、ご応募をお待ちしております。 試験実施時期:2016年11月 参加期間:17週間 内容:通院14回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年1月8日に「ミネブロR錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の高血圧症患者 治験薬投与前の血圧値が以下の基準の方 収縮期血圧140 mmHg以上180 mmHg未満かつ拡張期血圧80 mmHg以上110 mmHg未満 治験薬投与開始前4週間以上前から指定の降圧剤1種類を服用している方 |
| 募集期限 | 2016年11月11日 |
【高血圧症】未治療もしくは1剤まで治療中の方へ(関東)
| 問い合わせ番号 | 3876 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2016年8月 参加期間:約8ヶ月 内容:通院18回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年1月8日に「ミネブロR錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上70歳以下(男女不問)の方で、以下のいずれかの条件に該当する方 ①1剤で治療中の方で収縮期血圧(上)130以上/拡張期血圧(下)80以上の方 ②未治療の方で収縮期血圧(上)140以上/拡張期血圧(下)90以上の方 |
| 募集期限 | 2016年09月15日 |
【高血圧症】未治療もしくは1剤まで治療中の方へ(関西)
| 問い合わせ番号 | 3870 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2016年8月 参加期間:約8ヶ月 内容:通院18回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年1月8日に「ミネブロR錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上70歳以下(男女不問)の方で、以下のいずれかの条件に該当する方 ①1剤で治療中の方で収縮期血圧(上)130以上/拡張期血圧(下)80以上の方 ②未治療の方で収縮期血圧(上)140以上/拡張期血圧(下)90以上の方 |
| 募集期限 | 2016年09月30日 |
【高血圧症】1剤まで治療中の方へ(関東)
| 問い合わせ番号 | 3787 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2016年3月 参加期間:約14ヶ月 内容:通院20回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年1月8日に「ミネブロR錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上70歳以下(男女不問)の方で、以下のいづかれ条件に該当する方 ①1剤で治療中の方で収縮期血圧(上)130~140/拡張期血圧(下)80~90の方 ②未治療の方で収縮期血圧(上)140~179/拡張期血圧(下)90~109の方 |
| 募集期限 | 2016年05月20日 |
【高血圧症】1剤まで治療中の方へ(関西)
| 問い合わせ番号 | 3754 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2016年3月 参加期間:約14ヶ月 内容:通院20回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年1月8日に「ミネブロR錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上70歳以下(男女不問)の方で、以下のいずれかの条件に該当する方 ①1剤で治療中の方で収縮期血圧(上)130~140/拡張期血圧(下)80~90の方 ②未治療の方で収縮期血圧(上)140~179/拡張期血圧(下)90~109の方 |
| 募集期限 | 2016年06月06日 |
【高血圧症】腎機能障害を有する高血圧症患者対象(関西)
| 問い合わせ番号 | 3567 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 日本国内で高血圧症患者は4000万人以上にのぼると言われています。高血圧症患者には、未治療の方や、治療をしているが上手くコントロール出来ない方が多くいます。 今回は、そのような血圧が高く治療をしていない方や、治療をしているが血圧値のコントロールが不十分な方を対象に実施します。多くのご応募をお待ちしております。 試験実施時期;2015年5月 参加期間;16週間 内容;2泊3日+通院15回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の高血圧症患者 投与前の血圧値が、収縮期血圧140mmHg以上180mmHg未満かつ拡張期血圧80mmHg以上110mmHg未満の範囲内である方 |
| 募集期限 | 2015年06月28日 |
【高血圧症】血圧が高い方対象 通院試験
| 問い合わせ番号 | 3519 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2015年1月から 参加期間:約6ヵ月間 内容:通院12回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上70歳未満(男女不問)の方で、以下の条件に該当する方 ①未治療で収縮期血圧が150㎜Hg以上かつ拡張期血圧が100㎜Hg以上の方 ②2種類までの降圧剤を服用中で、収縮期血圧が140mmHg以上かつ拡張期血圧が90㎜Hg以上の方 |
| 募集期限 | 2015年05月31日 |
【高血圧症】血圧が高い方対象 通院試験
| 問い合わせ番号 | 3333 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2015年1月から 参加期間:約6ヵ月間 内容:通院12回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上70歳未満(男女不問)の方で、以下の条件に該当する方 ①未治療で収縮期血圧が150㎜Hg以上かつ拡張期血圧が100㎜Hg以上の方 ②2種類までの降圧剤を服用中で、収縮期血圧が140mmHg以上かつ拡張期血圧が90㎜Hg以上の方 |
| 募集期限 | 2015年03月31日 |
【高血圧症】血圧が高い患者を対象の入院試験と通院試験のご案内(関西)
| 問い合わせ番号 | 2988 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は血圧が高い方を対象に実施する治験です。 60名に参加いただく5泊6日の宿泊が含む試験日程と、25名に参加いただく通院のみの試験日程と2つの試験日程にわかれて実施致します。 会社の健康診断で血圧が高いと指摘を受けた方、ご応募ください。 お待ちしております。 試験実施時期:2012年8月 参加期間:12週間 内容:①5泊6日+通院10回 ②通院12回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上70歳以下の方 投与前の血圧測定で、収縮期血圧140mmHg以上180mmHg未満かつ拡張期血圧90mmHg以上110mmHg未満の範囲内である方 |
| 募集期限 | 2013年02月14日 |
【高血圧症】未治療で放置している方、血圧高値と指摘された事がある方(関西)
| 問い合わせ番号 | 3869 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 大規模通院試験に付き大募集中です。過去に血圧高値を指摘された事があるけど、最近の値がよくわからない、気になる方も是非お申込みください。無料検診実施中です。 試験実施時期:2016年10月 参加期間:約4ヶ月 内容:通院10回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳以下(男女不問)の方で、 ①現在未治療の方 ②収縮期血圧(上の血圧)が140mmHg以上/拡張期血圧(下の血圧)が90mmHg以上の方 |
| 募集期限 | 2017年12月14日 |
【高血圧症】未治療で放置している方、血圧高値と指摘された事がある方(関東)
| 問い合わせ番号 | 3875 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 大規模通院試験に付き只今大募集中です。過去に血圧高値を指摘された事があるけど、最近の値がよくわからない、気になる方も是非お申込みください。無料検診実施中。 試験実施時期:2016年10月 参加期間:約4ヶ月 内容:通院10回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳以下(男女不問)の方で、 ①現在未治療の方 ②収縮期血圧(上の血圧)が140mmHg以上/拡張期血圧(下の血圧)が90mmHg以上の方 |
| 募集期限 | 2017年12月14日 |
【高血圧症】土日通院可能だからサラリーマンの方にオススメです(関西)
| 問い合わせ番号 | 3907 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 大規模通院試験に付き、只今大募集中です。 2週間に1回の土日中心の日程だから平日が忙しいサラリーマンの方も参加可能です。 過去に血圧高値を指摘された事があるけど、最近の値がよくわからない、又は値が気になる方も是非お申込みください。無料検診実施中です。 試験実施時期:2016年10月 参加期間:約4ヶ月 内容:通院10回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳以下(男女不問)の方で、 ①現在未治療の方 ②収縮期血圧(上の血圧)が140mmHg以上/拡張期血圧(下の血圧)が90mmHg以上の方 |
| 募集期限 | 2017年12月14日 |
【1月から始まる長期試験!!その① 1/15(日)入院開始】3泊4日3セット+通院4回(関西)
| 問い合わせ番号 | 3993 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験実施時期;2016年12月 内容:3泊4日×3回+通院4回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳から39歳までの健康な日本人 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2017年01月15日 |
【45歳の方まで参加できる3月実施の長期宿泊試験】17泊18日+通院1回(関西)
| 問い合わせ番号 | 3574 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 定員数28名の17泊18日の長期宿泊試験です。学生の春休み期間と重なるため、応募が殺到することが予想されます。 お早めにご応募ください。 試験実施時期;2015年3月 内容:17泊18日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳から45歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2015年03月15日 |
【健康成人】5泊6日×2回セットの宿泊試験(関西)
| 問い合わせ番号 | 2798 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 1ヵ月間に5泊6日を2回する宿泊試験です。1回目の宿泊から2回目の宿泊まで1週間の期間が空くため、日程調整がしやすく応募が殺到すると予想される試験です。お早めにご応募ください。お待ちしております。 試験実施時期;2011年7月 内容:5泊6日×2回+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から45歳までの健康な日本人男性 BMI;18.5以上25.0未満 ※BMI=体重(kg)÷(身長(m))² 入院期間中、禁煙に協力できる方 |
| 募集期限 | 2012年03月14日 |
【健康成人】全体40名募集 15泊16日の超ロング試験(関西)
| 問い合わせ番号 | 2796 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は、健康な日本人男性に参加いただく15泊16日の長期宿泊型試験の募集です。全部で4試験あり、合計40名の大募集。 長期宿泊試験は会員にも大変人気の高い試験です。募集定員人数に達し次第、募集が終了しますので、お早めにご応募下さい。 お待ちしております。 試験実施時期;2011年7月 内容:15泊16日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から45歳までの健康な日本人男性 BMI;18.5以上25.0未満 ※BMI=体重(kg)÷(身長(m))² 入院期間中、禁煙に協力できる方 |
| 募集期限 | 2012年03月14日 |
【健康成人】48名の大募集!4泊5日+通院1回が6試験(関西)
| 問い合わせ番号 | 2611 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験実施時期;2010年12月 内容:4泊5日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年1月8日に「ミネブロ®錠1.25mg・2.5mg・5mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から45歳までの健康な日本人男性 BMI;18.5以上25.0未満 ※BMI=体重(kg)÷(身長(m))² 入院期間中、禁煙に協力できる方 |
| 募集期限 | 2011年07月14日 |
手軽に2泊3日!!【6/13(火)入院開始】2泊3日+通院1回(関西)
| 問い合わせ番号 | 4074 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験実施時期:2017年6月 内容:2泊3日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年2月15日に「オキシコドン注射液10㎎/50mg「第一三共」として販売承認されました。 |
| ご協力いただける方 | ・20歳から39歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=体重÷(身長×身長)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2017年06月12日 |
お手軽に2泊3日!!【10/26(水)入院開始】2泊3日2セット+通院1回
| 問い合わせ番号 | 3939 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験実施時期:2016年10月 内容:2泊3日×2回+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年2月15日に「オキシコドン注射液10㎎/50mg「第一三共」として販売承認されました。 |
| ご協力いただける方 | ・20歳から39歳までの健康な日本人 ・BMIが18.5以上24.9以下の方 *BMI=体重÷(身長×身長)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2016年10月23日 |
【気管支ぜんそく】 吸入ステロイドで喘息治療中の方対象(関西)
| 問い合わせ番号 | 3577 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験実施時期:2016年6月 参加期間:約3ヵ月(約12週間) 内容:通院5回程度 実施施設:大阪府吹田市 この治験で使用された治験薬は、2019年2月15日に「ブデホル吸入粉末剤30吸入/60吸入「MYL」」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上70歳以下(男女不問)の方で以下の全ての条件に該当する方 ①気管支喘息と診断されている ②吸入ステロイドを継続的に使用して、ぜんそく治療を行っている方 ③非喫煙者もしくは過去喫煙者(喫煙年数に制限あり) |
| 募集期限 | 2016年11月12日 |
【花粉症】親子で参加!3月から開始 短期通院試験(関東)
| 問い合わせ番号 | 3545 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は欧州を中心に50ヵ国以上で、アレルギー性鼻炎に対して広く使用されていますが、日本ではまだ販売されていないため、季節性アレルギー性鼻炎に対する新しい治療薬として日本で使えるようにするために行うこととなりました。 100名以上の花粉症患者に参加いただく大型の通院試験です。 花粉症でお悩みの方、ご応募お待ちしております。 試験実施時期:2015年3月 参加期間:約1ヵ月間 内容:通院5回 実施施設:東京都新宿区 この治験で使用された治験薬は、2017年9月27日に「ルパフィン錠10mg」として販売承認されました。 |
| ご協力いただける方 | 年齢12歳以上17歳以下(男女不問)の方とその親で、以下の条件に該当する方 ①スギ花粉飛散時期に鼻炎症状(鼻づまり、鼻水、くしゃみ)がある方 ②一定期間(治験開始2週間前から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 |
| 募集期限 | 2016年11月21日 |
【花粉症】親子で参加!3月から開始 短期通院試験(関西)
| 問い合わせ番号 | 3550 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は欧州を中心に50ヵ国以上で、アレルギー性鼻炎に対して広く使用されていますが、日本ではまだ販売されていないため、季節性アレルギー性鼻炎に対する新しい治療薬として日本で使えるようにするために行うこととなりました。 200名以上の花粉症患者に参加いただく大型の通院試験です。 花粉症でお悩みの方、ご応募お待ちしております。 試験実施時期:2015年3月 参加期間:約1ヵ月間 内容:通院5回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2017年9月27日に「ルパフィン錠10mg」として販売承認されました。 |
| ご協力いただける方 | 年齢12歳以上17歳以下(男女不問)の方とその親で、以下の条件に該当する方 ①スギ花粉飛散時期に鼻炎症状(鼻づまり、鼻水、くしゃみ)がある方 ②一定期間(治験開始2週間前から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 |
| 募集期限 | 2015年03月15日 |
【健康成人】60名募集!!狂犬病ワクチンの長期通院試験(関西)
| 問い合わせ番号 | 3045 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 狂犬病が未だに流行しているインド、中国、フィリピンなどのアジア諸国への旅行者が増えており、狂犬病ワクチンの需要は増えております。今回のワクチン試験は、既に世界52ヶ国以上で承認されている狂犬病ワクチンを海外から製品輸入して日本で販売することを目的として計画されています。 狂犬病ウィルスの抗体を得られることが予想されます。アジア諸国への渡航をお考えの方、ご応募お待ちしております。 試験実施時期:2012年6月 参加期:8ヶ月~最大14ヶ月 内容:通院6回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年3月26日に「ラビピュール筋注用」として販売承認されました。 |
| ご協力いただける方 | 20歳以上40歳以下の健康な日本人男性 花粉症などのアレルギー症状のない方 |
| 募集期限 | 2013年12月12日 |
【夏休みに参加できる長期宿泊試験】8泊9日+通院1回
| 問い合わせ番号 | 3487 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験実施時期:2014年9月 内容:8泊9日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年6月18日に「アジマイシン点眼液1%」として販売承認されました。 |
| ご協力いただける方 | ・20歳から35歳までの健康な日本人男性 ・BMIが17.6以上26.3以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2014年09月25日 |
35歳以上の方のおすすめ!【9/12(土)入院開始治験】4泊5日+通院3回
| 問い合わせ番号 | 3656 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、A型、B型インフルエンザウイルス感染症の治療薬です。既に吸入粉末剤として広く使用されていますが、高齢者や小児などの粉末剤の吸入が困難な患者のために、自然な呼吸を利用した吸入が可能となるネブライザー用吸入剤の開発を目的として実施します。 試験実施時期:2015年8月 内容:4泊5日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年6月18日に「イナビル吸入懸濁用160mgセット」として販売承認されました。 |
| ご協力いただける方 | ・20歳から45歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2015年09月10日 |
【健康成人】6月から12月にかけて計100名募集!8泊9日入院試験(関西)
| 問い合わせ番号 | 41 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性に参加いただく8泊9日の入院試験です。今回の試験は1試験10名参加の試験です。また本試験は6月から12月にかけて10試験あり、合計100名に参加いただく大型試験となります。多くのご応募お待ちしております。 試験実施時期:2008年6月 内容:8泊9日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年1月19日に「レキサルティ錠®1mg、2mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から40歳以下の健康な日本人男性 BMI;18.5以上24.9以下 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2008年12月11日 |
【アレルギー性結膜炎】日頃から眼の痒みを感じる方対象(関東)
| 問い合わせ番号 | 4071 |
|---|---|
| 実施地区 | 東京 |
| 説明 | アレルギー性結膜炎の症状がある方を対象に実施する試験です。日頃から眼に、そう痒感、眼脂、流涙、異物感を感じる方が参加対象となります。 多くのご応募をお待ちしております。 試験開始時期:2017年5月 参加期間:8週間 内容:通院6回 実施施設:東京都新宿区 この治験で使用された治験薬は、2019年9月20日に「アレジオン®LX点眼液0.1%」として販売承認されました。 |
| ご協力いただける方 | 20歳以上 両眼共に、アレルギー性結膜炎の自覚症状である、眼の掻痒感を強く感じる方 |
| 募集期限 | 2018年06月08日 |
【アレルギー性結膜炎】日頃から眼の痒みを感じる方対象(関西)
| 問い合わせ番号 | 4084 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | アレルギー性結膜炎の症状がある方を対象に実施する試験です。日頃から眼に、そう痒感、眼脂、流涙、異物感を感じる方が参加対象となります。 多くのご応募をお待ちしております。 試験開始時期:2017年5月 参加期間:8週間 内容:通院6回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年9月20日に「アレジオン®LX点眼液0.1%」として販売承認されました。 |
| ご協力いただける方 | 20歳以上 両眼共に、アレルギー性結膜炎の自覚症状である、眼の掻痒感を強く感じる方 |
| 募集期限 | 2018年06月08日 |
【健康成人】非喫煙者の方対象試験 4泊5日+通院1回(関西)
| 問い合わせ番号 | 3353 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 20歳から39歳までの健康な日本人男性を対象とした4泊5日の宿泊型試験です。多くのご応募をお待ちしております。 試験開始時期:2014年2月 内容:4泊5日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2019年9月20日に「ラスビック錠75mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から39歳までの健康な日本人男性 BMI:18.5以上24.9以下の方 関西圏にお住まいの方 健康診断の結果より参加可能で、かつ定められた宿泊日程と通院日程に来院できる方 |
| 募集期限 | 2014年02月13日 |
【高血圧症】治療をしているが血圧が高い方対象(関西)
| 問い合わせ番号 | -4520 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は降圧剤です。会社の健康診断で血圧値が高いと指摘された方や、現在治療しているがまだ血圧値が高い方が対象の通院試験です。たくさんのご応募をお待ちしております。 試験開始時期:2007年9月 参加期間:16週間 内容:通院9回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年1月20日に「レザルタス配合錠ⓇLD/HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 以下の基準のどちらかに該当する方 (降圧剤で治療している方) 収縮期血圧140mmHg以上180mmHg未満かつ拡張期血圧90mmHg以上110mmHg未満 (降圧剤で治療していない方) 収縮期血圧140mmHg以上180mmHg未満かつ拡張期血圧90mmHg以上110mmHg未満を満たし、 さらに「収縮期血圧160mmHg以上」、「拡張期血圧100mmHg以上」のいずれかまたは両方の基準を満たすこと |
| 募集期限 | 2008年07月07日 |
【高血圧症】治療をしているが血圧が高い方対象(関東)
| 問い合わせ番号 | -4338 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は降圧剤です。会社の健康診断で血圧値が高いと指摘された方や、現在治療しているがまだ血圧値が高い方が対象の通院試験です。たくさんのご応募をお待ちしております。 試験開始時期:2007年9月 参加期間:16週間 内容:通院9回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年1月20日に「レザルタス配合錠ⓇLD/HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 以下の基準のどちらかに該当する方 (降圧剤で治療している方) 収縮期血圧140mmHg以上180mmHg未満かつ拡張期血圧90mmHg以上110mmHg未満 (降圧剤で治療していない方) 収縮期血圧140mmHg以上180mmHg未満かつ拡張期血圧90mmHg以上110mmHg未満を満たし、 さらに「収縮期血圧160mmHg以上」、「拡張期血圧100mmHg以上」のいずれかまたは両方の基準を満たす |
| 募集期限 | 2008年07月07日 |
【高血圧症】軽症・中等症本態性高血圧症患者を対象(関東)
| 問い合わせ番号 | -4357 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は降圧剤です。会社の健康診断で血圧値が高いと指摘された方や、現在治療しているがまだ血圧値が高い方が対象の通院試験です。100名規模で実施しますので、たくさんのご応募をお待ちしております。 試験開始時期:2006年7月 参加期間:16週間 内容:通院10回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年1月20日に「レザルタス配合錠ⓇLD/HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上 治験薬を使用する前の検査で以下の基準に該当する方 収縮期血圧140 mmHg以上180 mmHg未満かつ拡張期血圧90 mmHg以上110 mmHg未満 |
| 募集期限 | 2007年12月07日 |
【高血圧症】軽症・中等症本態性高血圧症患者を対象(関西)
| 問い合わせ番号 | -4647 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は降圧剤です。会社の健康診断で血圧値が高いと指摘された方や、現在治療しているがまだ血圧値が高い方が対象の通院試験です。30名規模で実施しますので、たくさんのご応募をお待ちしております。 試験開始時期:2006年7月 参加期間:16週間 内容:通院10回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2010年1月20日に「レザルタス配合錠ⓇLD/HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上 治験薬を使用する前の検査で以下の基準に該当する方 収縮期血圧140 mmHg以上180 mmHg未満かつ拡張期血圧90 mmHg以上110 mmHg未満 |
| 募集期限 | 2007年12月07日 |
【高血圧症】軽症・中等症本態性高血圧症患者を対象(関西)
| 問い合わせ番号 | -4648 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は降圧剤です。会社の健康診断で血圧値が高いと指摘された方や、現在治療しているがまだ血圧値が高い方が対象の通院試験です。100名規模で実施しますので、たくさんのご応募をお待ちしております。 試験開始時期:2006年7月 参加期間:16週間 内容:通院10回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年1月20日に「レザルタス配合錠ⓇLD/HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上 治験薬を使用する前の検査で以下の基準に該当する方 収縮期血圧140 mmHg以上180 mmHg未満かつ拡張期血圧90 mmHg以上110 mmHg未満 |
| 募集期限 | 2007年12月07日 |
【健康成人】夏休み期間に実施 2泊3日×2回宿泊型試験(関西)
| 問い合わせ番号 | -4442 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2008年8月 内容:2泊3日×2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2010年2月4日に「オメプラゾール錠10mg「アメル」」として販売承認されました。 |
| ご協力いただける方 | 健康な日本人男性 20歳以上35歳以下 BMI;17.6以上26.4以下 |
| 募集期限 | 2008年09月06日 |
【ドライアイ】眼が疲れやすい、ショボショボする等の不快感がある方対象(関西)
| 問い合わせ番号 | -4599 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、ドライアイの点眼薬となります。角膜や結膜などの傷を改善するという作用を持つ薬剤であり、ドライアイに対して新たな治療を提供できることが期待されています。日頃から眼がショボショボやゴロゴロを感じる方、眼が疲れやすい方など是非ご応募下さい。 試験開始時期:2006年8月 参加期間:最大54週間 内容:通院最大16回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2010年4月16日に「ジクアス点眼液3%」として販売承認されました。 |
| ご協力いただける方 | 以下のような症状を感じる方が対象です。 ・目が疲れやすい ・目がショボショボ、ゴロゴロする ・目が重たいと感じることが多い ・目が乾いた感じがする ・なんとなく目に不快感がある ・ものがかすんで見える ・目がかゆい ・光がまぶしく感じやすい |
| 募集期限 | 2008年04月06日 |
【高尿酸血症】腎機能低下患者を対象とした宿泊型試験(関東)
| 問い合わせ番号 | 4767 |
|---|---|
| 実施地区 | |
| 説明 | 今回のお薬は高尿酸血症の治療薬です。尿酸を作る酵素の働きを抑え、血液中に含まれる尿酸の量を少なくする、これまで発売されている高尿酸血症の治療薬とは異なる作用の新しいお薬です。 試験開始時期:2000年9月 内容:2泊3日+通院1回 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年1月21日に「フェブリク錠10mg/フェブリク錠20mg/フェブリク錠40mg 」として販売承認されました。 |
| ご協力いただける方 | 20歳以上65歳未満 以下のどちらかの基準に該当する方 (1) 正常群 80mL/min≦Ccr (2) 中等度低下群 30mL/min≦Ccr<50mL/min |
| 募集期限 | 2001年03月01日 |
【痛風・高尿酸血症】尿酸血が高い方を対象とした通院型試験(関西)
| 問い合わせ番号 | 4766 |
|---|---|
| 実施地区 | |
| 説明 | 今回のお薬は、痛風・高尿酸血症の治療薬です。血液中の尿酸を作り出す酵素の作用を抑えることにより、血液中の尿酸の値を下げ、痛風・高尿酸血症を改善することが期待されている薬剤です。会社の健康診断で、尿酸血が高いと指摘された方はぜひご応募ください。 試験開始時期:2002年9月 参加期間:最大11週間 内容:通院5~6回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年1月21日に「フェブリク錠」として販売承認されました。 |
| ご協力いただける方 | 20才から65才未満の方 血液中の尿酸値が8.0ml/dl以上 |
| 募集期限 | 2003年06月01日 |
【痛風・高尿酸血症】尿酸血が高い方を対象とした通院型試験(関東)
| 問い合わせ番号 | 4765 |
|---|---|
| 実施地区 | |
| 説明 | 今回のお薬は、痛風・高尿酸血症の治療薬です。血液中の尿酸を作り出す酵素の作用を抑えることにより、血液中の尿酸の値を下げ、痛風・高尿酸血症を改善することが期待されている薬剤です。会社の健康診断で、尿酸血が高いと指摘された方はぜひご応募ください。 試験開始時期:2001年6月 参加期間:最大10週間 内容:通院5回 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年1月21日に「フェブリク錠」として販売承認されました。 |
| ご協力いただける方 | 20才から65才未満の方 血液中の尿酸値が8.0ml/dl以上 |
| 募集期限 | 2002年03月01日 |
【痛風・高尿酸血症】尿酸血が高い方を対象とした通院型試験(関西)
| 問い合わせ番号 | 4764 |
|---|---|
| 実施地区 | |
| 説明 | 今回のお薬は、痛風・高尿酸血症の治療薬です。血液中の尿酸を作り出す酵素の作用を抑えることにより、血液中の尿酸の値を下げ、痛風・高尿酸血症を改善することが期待されている薬剤です。会社の健康診断で、尿酸血が高いと指摘された方はぜひご応募ください。 試験開始時期:2001年6月 参加期間:最大10週間 内容:通院5回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年1月21日に「フェブリク錠」として販売承認されました。 |
| ご協力いただける方 | 20才から65才未満の方 血液中の尿酸値が8.0ml/dl以上 |
| 募集期限 | 2002年03月01日 |
【痛風・高尿酸血症】尿酸血が高い方を対象とした通院型試験(関西)
| 問い合わせ番号 | 4763 |
|---|---|
| 実施地区 | |
| 説明 | 今回のお薬は、痛風・高尿酸血症の治療薬です。体内の尿酸産生量を低下させる効果があると期待させれている薬剤です。会社の健康診断で、尿酸血が高いと指摘された方はぜひご応募ください。 試験開始時期:2000年7月 参加期間:最大11週間 内容:通院5回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年1月21日に「フェブリク錠」として販売承認されました。 |
| ご協力いただける方 | 20才から65才未満の方 痛風、高尿酸血症の患者さんで血清尿酸値が7.0mg/dl以上の方 |
| 募集期限 | 2001年03月01日 |
【健康成人】8月から開始 2泊3日×2回(関西)
| 問い合わせ番号 | -4443 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、既に承認販売されている緑内障の点眼薬に含まれる防腐剤を含まない、新しい点眼薬の開発です。8月から開始する試験です、多くのご応募をお待ちしております。 試験開始時期:2008年8月 内容:2泊3日×2回+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2010年7月15日に「ラタノプロスト点眼液0.005%「わかもと」」として販売承認されました。 |
| ご協力いただける方 | 20歳から35歳の健康な日本人男性 矯正視力が1.0以上の方 スクリーニング時に測定する眼圧の数値が、10mmHg以上21mmHg以下 |
| 募集期限 | 2008年08月28日 |
【健康成人】夏休み期間に実施、9泊10日の宿泊試験(関西)
| 問い合わせ番号 | -4446 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 夏休み期間中に実施する、9泊10日の長期宿泊試験。とても人気の高い長期宿泊試験です。特にこの学生の応募が殺到し、直ぐに募集定員がうまります。お早めにご応募下さい。 試験開始時期:2008年7月 内容:9泊10日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2010年12月21日に「クラビット点眼液1.5%」として販売承認されました。 |
| ご協力いただける方 | 20歳から35歳までの健康な日本人男性 関西地区在住 |
| 募集期限 | 2008年09月28日 |
【高尿酸血症】3泊4日の宿泊型試験(関東)
| 問い合わせ番号 | 4761 |
|---|---|
| 実施地区 | |
| 説明 | 今回のお薬は高尿酸血症の治療薬です。尿酸を作る酵素の働きを抑え、血液中に含まれる尿酸の量を少なくする、これまで発売されている高尿酸血症の治療薬とは異なる作用の新しいお薬です。腎機能が低下している患者にも安心して使用できるお薬として期待されています。 試験開始時期:2000年9月 内容:3泊4日 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年1月21日に「フェブリク錠10mg/フェブリク錠20mg/フェブリク錠40mg 」として販売承認されました。 |
| ご協力いただける方 | 20歳以上65歳未満 以下の基準を満たす腎機能(指標:クレアチニンクリアランス)を有する方 ・腎機能正常 :クレアチニンクリアランスが80ml/min以上 ・軽度腎機能低下 :クレアチニンクリアランスが80未満50ml/min以上 ・中等度腎機能低下:クレアチニンクリアランスが50未満30ml/min以上 |
| 募集期限 | 2001年09月27日 |
【高血圧症】血圧が高い方を対象とした55週間の長期通院型試験(関東)
| 問い合わせ番号 | -4349 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は、高血圧症の治療薬です。アンジオテンシンⅡ受容体拮抗薬と呼ばれるお薬とカルシウム拮抗薬と呼ばれるお薬の配合剤となります。 それぞれのお薬の特徴が互いに助け合って働くことで、より効果的に血圧を下げることが期待されております。 試験参加期間:2007年1月 参加期間:55週間 内容:通院23回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年1月20日に「エックスフォージ配合錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の男女 高血圧症と診断された方 |
| 募集期限 | 2008年12月27日 |
【高血圧症】血圧が高い方を対象とした55週間の長期通院型試験(関西)
| 問い合わせ番号 | 23 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、高血圧症の治療薬です。アンジオテンシンⅡ受容体拮抗薬と呼ばれるお薬とカルシウム拮抗薬と呼ばれるお薬の配合剤となります。 それぞれのお薬の特徴が互いに助け合って働くことで、より効果的に血圧を下げることが期待されております。 試験参加期間:2007年1月 参加期間:55週間 内容:通院23回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年1月20日に「エックスフォージ配合錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の男女 高血圧症と診断された方 |
| 募集期限 | 2008年12月27日 |
【高血圧症】血圧が高い方を対象とした通院型試験(関西)
| 問い合わせ番号 | -4592 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、高血圧症の治療薬です。アンジオテンシンⅡ受容体拮抗薬と呼ばれるお薬とカルシウム拮抗薬と呼ばれるお薬の配合剤となります。 それぞれのお薬の特徴が互いに助け合って働くことで、より効果的に血圧を下げることが期待されております。 試験参加期間:2006年11月 参加期間:3ヵ月間 内容:通院8回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2010年1月20日に「エックスフォージ配合錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の男女 高血圧症と診断された方 |
| 募集期限 | 2008年05月27日 |
【高血圧症】血圧が高い方を対象とした通院型試験(関東)
| 問い合わせ番号 | -4350 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は、高血圧症の治療薬です。アンジオテンシンⅡ受容体拮抗薬と呼ばれるお薬とカルシウム拮抗薬と呼ばれるお薬の配合剤となります。 それぞれのお薬の特徴が互いに助け合って働くことで、より効果的に血圧を下げることが期待されております。 試験参加期間:2006年12月 参加期間:3ヵ月間 内容:通院8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年1月20日に「エックスフォージ配合錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の男女 高血圧症と診断された方 |
| 募集期限 | 2008年05月27日 |
【高血圧症】血圧が高い方を対象とした通院型試験(関西)
| 問い合わせ番号 | -4593 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、高血圧症の治療薬です。アンジオテンシンⅡ受容体拮抗薬と呼ばれるお薬とカルシウム拮抗薬と呼ばれるお薬の配合剤となります。 それぞれのお薬の特徴が互いに助け合って働くことで、より効果的に血圧を下げることが期待されております。 試験参加期間:2006年11月 参加期間:3ヵ月間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年1月20日に「エックスフォージ配合錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の男女 高血圧症と診断された方 |
| 募集期限 | 2008年04月27日 |
【健康成人】学生必見!春休みの時期より実施、10泊11日宿泊型試験(関西)
| 問い合わせ番号 | -4409 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 春休みシーズンより実施します、10泊11日+通院1回の宿泊型試験。就職までの残り僅かの学生生活を愉しんでいる4回生の皆さん、是非この機会に治験に参加してみてはいかかがでしょうか。多くの学生からのご応募お待ちしております。 試験開始時期:2006年2月 内容:10泊11日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年1月21日に「フェブリク錠10mg/フェブリク錠20mg/フェブリク錠40mg 」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳未満の健康な日本人男性 BMI:18.5以上25.0未満 ※BMI=体重(㎏)÷(身長(m))² |
| 募集期限 | 2006年07月27日 |
【健康成人】2泊3日+3泊4日×3回(参加期間:1ヵ月間) (関西)
| 問い合わせ番号 | -4500 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、アルツハイマー型認知症の治療薬です。海外では既に承認販売されているお薬です。アルツハイマー型認知症の患者の多くが、高齢者のため、錠剤を服用(嚥下)することが難しい。そのため口腔内で速やかに崩壊するタイプの錠剤が求められており、今回の開発に至った。 試験参加時期:2007年8月 内容:2泊3日+3泊4日×3回+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年1月21日に「レミニールOD錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上40歳未満の健康な日本人男性 BMI:17.6以上26.4以下 ※BMI=体重(kg)÷(身長(m))² 非喫煙者 |
| 募集期限 | 2008年04月24日 |
【健康成人】9月募集開始!1ヶ月間宿泊する長期宿泊試験(関西)
| 問い合わせ番号 | -4611 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回の試験は、健康な男性に参加いただき、1ヵ月間宿泊する、超ロング宿泊試験です。応募が殺到し、直ぐに受付終了となりますので、お早めにご応募ください。 試験開始時期:2006年9月 内容:28泊29日+通院1回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年4月22日に「ミラペックスLA錠」として販売承認されました。 |
| ご協力いただける方 | 20歳から40歳までの健康な日本人男性 BMI:17.6以上26.4以下 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2006年11月23日 |
【健康成人】3月から募集開始 3泊4日+2回の宿泊型試験(関西)
| 問い合わせ番号 | 248 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2009年4月 内容:3泊4日×2回+通院2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年4月22日に「リクシアナ錠15mg/リクシアナ錠30mg 」として販売承認されました。 |
| ご協力いただける方 | 20歳以上40歳以下の健康な日本人男性 BMI:18.5以上25.0未満 ※BMI=体重(kg)÷(身長(m))² 入院期間中に、禁煙が守れる方 |
| 募集期限 | 2009年07月23日 |
【健康成人】2ヵ月間に6泊7日×3回の宿泊型試験(関西)
| 問い合わせ番号 | -4456 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2008年4月 内容:6泊7日×3回+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年7月1日に「ネキシウムⓇカプセル」として販売承認されました。 |
| ご協力いただける方 | 20歳から45歳までの健康な日本人男性 BMI:19.0以上27.0以下 体重:50Kg以上80㎏以下 |
| 募集期限 | 2008年07月23日 |
【高血圧症】治療の有無問わず血圧が高い方対象(関西)
| 問い合わせ番号 | 299 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は降圧剤のお薬です。従来の降圧剤に比べて強力な降圧効果や臓器・組織の保護作用が期待できる、全く新しい降圧剤です。 軽度、中等症高血圧症患者に多く参加いただく試験です。会社の健康診断で血圧が高いと指摘を受けた方、是非一度ご応募下さい。 試験実施時期:2009年4月 参加期間:20週間 内容:通院11回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年1月28日に「アジルバⓇ錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上で血圧の数値が高い方 試験開始から治験薬投与までの血圧測定で以下のすべての基準に合致する方 座位拡張期血圧:95 mmHg以上110 mmHg未満 座位収縮期血圧:150 mmHg以上180 mmHg未満 |
| 募集期限 | 2010年08月22日 |
【高血圧症】全国40施設で実施する他施設合同の通院型試験(関西)
| 問い合わせ番号 | -4558 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は降圧剤のお薬です。従来の降圧剤に比べて強力な降圧効果や臓器・組織の保護作用が期待できる、全く新しい降圧剤です。 軽度、中等症高血圧症患者に多く参加いただく試験です。会社の健康診断で血圧が高いと指摘を受けた方、是非一度ご応募下さい。 試験実施時期:2007年5月 参加期間:16週間 内容:通院9回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年1月28日に「アジルバⓇ錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上で血圧の数値が高い方 試験開始から治験薬投与までの血圧測定で以下のすべての基準に合致する方 座位拡張期血圧:95 mmHg以上110 mmHg未満 座位収縮期血圧:150 mmHg以上180 mmHg未満 |
| 募集期限 | 2008年07月22日 |
【健康成人】4泊5日+通院1回を2セット(関西)
| 問い合わせ番号 | 2354 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は降圧剤のお薬です。従来の降圧剤に比べて強力な降圧効果や臓器・組織の保護作用が期待できる、全く新しい降圧剤です。 試験開始時期:2010年2月 内容:4泊5日×2回+通院2回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年1月28日に「アジルバⓇ錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の健康な日本人男性 体重:50Kg以上 BMI:17.6以上26.4以下 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2010年04月22日 |
【健康成人】64名の募集 4泊5日宿泊型試験(関西)
| 問い合わせ番号 | -4662 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は降圧剤のお薬です。従来の降圧剤に比べて強力な降圧効果や臓器・組織の保護作用が期待できる、全く新しい降圧剤です。 試験開始時期:2006年5月 内容:ステップ1~3 4泊5日+通院1回(36名) ステップ4~5 4泊5日×2回+通院2回(28名) 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年1月28日に「アジルバⓇ錠」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の健康な日本人男性 体重:50Kg以上 BMI:17.6以上26.4以下 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2006年08月22日 |
【高齢者】100名大募集!!65歳以上の高齢者対象通院型試験(関西)
| 問い合わせ番号 | -4519 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、緑内障の治療点眼薬です。緑内障の危険因子である眼圧を下げるための優れた点眼薬は幾つかあります。今回、開発された点眼薬はこれまで承認販売されている点眼薬とは異なる、全く新しい作用で眼圧を下げる点眼薬です。 試験開始時期:2007年9月 参加期間:4週間 内容:通院4回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年1月18日に「アイファガン点眼液01.%」として販売承認されました。 |
| ご協力いただける方 | 65歳以上の男女 心電図所見に異常がみられない方 以下の条件を全て該当する方 ①収縮期血圧値(上の血圧値)100以上160mmHg未満 ②拡張期血圧値(下の血圧値)60以上90未満 |
| 募集期限 | 2008年05月22日 |
【健康成人】Ⅰ期、Ⅱ期と2回入院する宿泊型試験(関西)
| 問い合わせ番号 | 387 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は「統合失調症」の治療薬です。既に承認発売されているお薬ですが、嚥下困難な患者や錠剤が投与できない患者向けに、水なしでどこでも服用できる口腔崩壊錠として承認を得る目的で実施する試験です。 試験開始時期:2010年1月 内容5泊6日×2回+通院2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年1月18日に「エビリファイOD錠3mg」として販売承認されました。 |
| ご協力いただける方 | 健康な日本人男性 年齢:20歳以上40歳未満 BMI:18.5以上25.0未満 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2010年07月21日 |
【健康成人】5泊6日×2回セットの宿泊型試験(関西)
| 問い合わせ番号 | 2351 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は「統合失調症」の治療薬です。既に承認発売されているお薬ですが、嚥下困難な患者や錠剤が投与できない患者向けに、水なしでどこでも服用できる口腔崩壊錠として承認を得る目的で実施する試験です。 試験開始時期:2010年1月 内容5泊6日×2回+通院2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年1月18日に「エビリファイOD錠3mg」として販売承認されました。 |
| ご協力いただける方 | 健康な日本人男性 年齢:20歳以上40歳未満 BMI:18.5以上25.0未満 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2010年07月21日 |
【健康成人】健康な日本人男性対象の3泊4日の宿泊型試験(関西)
| 問い合わせ番号 | -4581 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、パーキンソン病の治療薬です。このパーキンソン病は中高年になるほど発症する割合が高くなり、患者数は100万に100人から150人ぐらいいるといわれています。 試験開始時期:2007年3月 内容:3泊4日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年3月30日に「アポカインⓇ皮下注30mg」として販売承認されました。 |
| ご協力いただける方 | 20歳~45歳未満の日本人男性 BMI:17.6以上26.4以下 ※BMI=体重(kg)÷(身長(m))² 試験開始の4週間以上前から喫煙していない方 |
| 募集期限 | 2007年07月07日 |
【健康成人】健康な男性と女性が参加対象の2泊3日宿泊試験(関西)
| 問い合わせ番号 | -4584 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、便秘症の治療薬です。海外ではすでに先行して治験が行われていますが、日本では今回が初めて実施します。 試験開始時期:2007年2月 内容:2泊3日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年6月29日に「アミティーザⓇ」として販売承認されました。 |
| ご協力いただける方 | 20歳から45歳までの健康な日本人男性と女性 BMI:17.6以上26.4以下の方 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2007年05月05日 |
【高血圧症】全国10施設合同で実施する通院型試験(関西)
| 問い合わせ番号 | 2585 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は、高血圧症の治療薬の試験です。高血圧症以外の合併症のある患者の大部分は目標血圧を達成するために、複数降圧剤を服用しているケースが多いです。本試験は、ARBであるテルミサルタンとカルシウム拮抗薬であるアムロジピンを併用している患者の服薬コンプライスの向上を目的に、開発される配合剤の試験となります。 試験開始時期:2010年9月 参加期間:約6ヵ月間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年12月21日に「ミカムロⓇ配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 2回目の来院時の血圧値が、以下の基準を満たしている方 服薬有:拡張期血圧値(下の血圧値)90mmHg以上150mmHg未満 服薬無:拡張期血圧値(下の血圧値)95mmHg以上150mmHg未満 |
| 募集期限 | 2011年12月21日 |
【高血圧症】既治療や未治療の方対象の通院型試験(関西)
| 問い合わせ番号 | 2541 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は、高血圧症の治療薬の試験です。高血圧症以外の合併症のある患者の大部分は目標血圧を達成するために、複数降圧剤を服用しているケースが多いです。本試験は、ARBであるテルミサルタンとカルシウム拮抗薬であるアムロジピンを併用している患者の服薬コンプライスの向上を目的に、開発される配合剤の試験となります。 試験開始時期:2010年9月 参加期間:6ヵ月間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年12月21日に「ミカムロⓇ配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 2回目の来院時の血圧値が、以下の基準を満たしている方 服薬有:拡張期血圧値(下の血圧値)90mmHg以上150mmHg未満 服薬無:拡張期血圧値(下の血圧値)95mmHg以上150mmHg未満 |
| 募集期限 | 2011年08月21日 |
【高血圧症】既治療や未治療の方対象の通院型試験(関東)
| 問い合わせ番号 | 2549 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回は、高血圧症の治療薬の試験です。高血圧症以外の合併症のある患者の大部分は目標血圧を達成するために、複数降圧剤を服用しているケースが多いです。本試験は、ARBであるテルミサルタンとカルシウム拮抗薬であるアムロジピンを併用している患者の服薬コンプライスの向上を目的に、開発される配合剤の試験となります。 試験開始時期:2010年9月 参加期間:6ヵ月間 内容:通院8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2012年12月21日に「ミカムロⓇ配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 2回目の来院時の血圧値が、以下の基準を満たしている方 服薬有:拡張期血圧値(下の血圧値)90mmHg以上150mmHg未満 服薬無:拡張期血圧値(下の血圧値)95mmHg以上150mmHg未満 |
| 募集期限 | 2011年08月21日 |
【混合ワクチン】1ヵ月間の短期通院型治験(関西)
| 問い合わせ番号 | -4540 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のワクチンは百日せきジフテリア破傷風不活化ポリオの4種混合ワクチンの開発を目的とした通院型ワクチン試験です。1ヵ月間に通院3回と短期間で終了する試験です。宿泊型の治験になかなか参加出来ない方は、是非ご応募下さい。 試験開始時期:2007年7月 参加期間:約1ヵ月間 内容:通院3回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年7月27日に「クアトロバックⓇ皮下注シリンジ」として販売承認されました。 |
| ご協力いただける方 | 20歳以上40歳以下の日本人男性 BMI:17.6以上26.5未満 これまでに食物や医薬品でアナフィラキシー症状がでたことがない方 |
| 募集期限 | 2008年03月20日 |
【高トリグリセライド血症】中性脂肪が高い方対象の通院試験(関東)
| 問い合わせ番号 | 396 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は、高トリグリセライド血症の治療薬です。トリグリセライド(中性脂肪)が高い状態を放置していると徐々に血管内に脂肪がたまり血管の弾力がなくなり、硬くなる状態、いわゆる動脈硬化へと進行します。その状態が進行すると心筋梗塞などを引き起こす可能性があります。既に、米国、英国、仏、独など世界49ヵ国に承認発売されている薬剤です。会社の検診にて中性脂肪が高いと指摘を受けた、ご応募をお待ちしております。 試験開始時期:2009年10月 参加期間:5ヵ月間 内容:通院8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2012年9月28日に「ロトリガ粒状カプセルⓇ」として販売承認されました。 |
| ご協力いただける方 | 20歳以上75歳以下の男女 生活習慣の改善指導を病院より受けている方 試験の初回来院時の検査にて、トリグリセライド値(TG)が150mg/dL以上750mg/dL未満の方 |
| 募集期限 | 2011年01月20日 |
【高トリグリセライド血症】中性脂肪が高い方対象の通院試験(関西)
| 問い合わせ番号 | 2349 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、高トリグリセライド血症の治療薬です。トリグリセライド(中性脂肪)が高い状態を放置していると徐々に血管内に脂肪がたまり血管の弾力がなくなり、硬くなる状態、いわゆる動脈硬化へと進行します。その状態が進行すると心筋梗塞などを引き起こす可能性があります。既に、米国、英国、仏、独など世界49ヵ国に承認発売されている薬剤です。会社の検診にて中性脂肪が高いと指摘を受けた、ご応募をお待ちしております。 試験開始時期:2009年10月 参加期間:5ヵ月間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年9月28日に「ロトリガ粒状カプセルⓇ」として販売承認されました。 |
| ご協力いただける方 | 20歳以上75歳以下の男女 生活習慣の改善指導を病院より受けている方 試験の初回来院時の検査にて、トリグリセライド値(TG)が150mg/dL以上750mg/dL未満の方 |
| 募集期限 | 2011年11月20日 |
【高脂血症】大募集!!中性脂肪の数値が高い方(関西)
| 問い合わせ番号 | 30 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、高トリグリセライド血症の治療薬です。トリグリセライド(中性脂肪)が高い状態を放置していると徐々に血管内に脂肪がたまり血管の弾力がなくなり、硬くなる状態、いわゆる動脈硬化へと進行します。その状態が進行すると心筋梗塞などを引き起こす可能性があります。そうなる前に、会社の健康診断などでトリグリセライド値(中性脂肪)が高いと指摘された方はこの機会に是非ご応募ください。 試験開始時期:2007年10月 参加期間:20週間 内容:8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年9月28日に「ロトリガ粒状カプセルⓇ」として販売承認されました。 |
| ご協力いただける方 | 20歳以上75歳以下の男女 試験の初回来院時の検査にて、トリグリセライド値(TG)が150mg/dL以上750mg/dL未満の方 |
| 募集期限 | 2009年01月20日 |
【健康成人】3泊4日×2回、宿泊型試験(関西)
| 問い合わせ番号 | 2411 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、降圧剤です。お薬の特徴は、それぞれが異なる作用で血圧を下げる2つのお薬を1つにまとめた「配合剤」です。2つのお薬を服薬している患者の方にとって、1つになった「配合剤」で呑み忘れ等もなくなり、服薬コンプライアンスの向上に繋がると期待されているお薬です。多くのご応募をお待ちしております。 試験開始時期:2010年4月 内容3泊4日×2+通院2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年9月28日に「アイミクス配合錠LD/HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上40歳未満の健康な日本人男性 BMI:18.5以上25.0未満 ※BMI=体重(Kg)÷(身長(m))² 体重:50Kg以上80㎏未満 |
| 募集期限 | 2010年09月20日 |
【腸管洗浄液】最大60名に参加いただく入院試験(関西)
| 問い合わせ番号 | 2369 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、腸管洗浄液です。大腸の内視鏡検査前や大腸の手術前の処置として腸管の内容物を排除するために使用する洗浄剤です。 試験開始時期:2010年2月 内容:ステップ①4泊5日 ステップ②2泊3日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年12月25日に「モビプレップⓇ配合内用剤」として販売承認されました。 |
| ご協力いただける方 | 20歳以上46歳未満の健康な日本人男性 BMIが18.5以上25.0未満 ※BMI=体重(㎏)÷(身長(m))² |
| 募集期限 | 2010年06月17日 |
【高血圧症】降圧剤で治療している方対象の通院型試験(関東)
| 問い合わせ番号 | -4337 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回は、高血圧症の治療薬の試験です。高血圧症以外の合併症のある患者の大部分は目標血圧を達成するために、複数降圧剤を服用しているケースが多いです。本試験は、ARBであるテルミサルタンとカルシウム拮抗薬であるアムロジピンを併用している患者の服薬コンプライスの向上を目的に、開発される配合剤の試験となります。 試験開始時期:2007年11月 参加期間:16週間 内容:通院7回 実施施設:東京都新宿区 この治験で使用された治験薬は、2012年12月21日に「ミカムロⓇ配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 高血圧症と診断されている方 2回目の来院時の血圧値が、以下の基準を全て満たしている方 ①拡張期血圧値(下の血圧)が95 mmHg以上かつ114 mmHg以下 ②収縮期血圧値(上の血圧)が140 mmHg以上かつ200 mmHg以下 試験開始までに現在使用している降圧剤を中止し、試験が指定する降圧剤に切り替えることができる方 |
| 募集期限 | 2009年12月17日 |
【高血圧症】降圧剤で治療している方対象の通院型試験(関西)
| 問い合わせ番号 | 29 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は、高血圧症の治療薬の試験です。高血圧症以外の合併症のある患者の大部分は目標血圧を達成するために、複数降圧剤を服用しているケースが多いです。本試験は、ARBであるテルミサルタンとカルシウム拮抗薬であるアムロジピンを併用している患者の服薬コンプライスの向上を目的に、開発される配合剤の試験となります。 試験開始時期:2007年11月 参加期間:16週間 内容:通院7回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年12月21日に「ミカムロⓇ配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 高血圧症と診断されている方 2回目の来院時の血圧値が、以下の基準を全て満たしている方 ①拡張期血圧値(下の血圧)が95 mmHg以上かつ114 mmHg以下 ②収縮期血圧値(上の血圧)が140 mmHg以上かつ200 mmHg以下 試験開始までに現在使用している降圧剤を中止し、試験が指定する降圧剤に切り替えることができる方 |
| 募集期限 | 2008年09月17日 |
【高血圧症】降圧剤で治療している方対象の通院型試験(関西)
| 問い合わせ番号 | 28 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は、高血圧症の治療薬の試験です。高血圧症以外の合併症のある患者の大部分は目標血圧を達成するために、複数降圧剤を服用しているケースが多いです。本試験は、ARBであるテルミサルタンとカルシウム拮抗薬であるアムロジピンを併用している患者の服薬コンプライスの向上を目的に、開発される配合剤の試験となります。 試験開始時期:2007年11月 参加期間:16週間 内容:通院7回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年12月21日に「ミカムロⓇ配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 高血圧症と診断されている方 2回目の来院時の血圧値が、以下の基準を全て満たしている方 ①拡張期血圧値(下の血圧)が95 mmHg以上かつ114 mmHg以下 ②収縮期血圧値(上の血圧)が140 mmHg以上かつ200 mmHg以下 試験開始までに現在使用している降圧剤を中止し、試験が指定する降圧剤に切り替えることができる方 |
| 募集期限 | 2008年10月17日 |
【高血圧症】降圧剤で治療している方対象の長期通院型試験(関西)
| 問い合わせ番号 | 32 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は、高血圧症の治療薬の試験です。高血圧症以外の合併症のある患者の大部分は目標血圧を達成するために、複数降圧剤を服用しているケースが多いです。本試験は、ARBであるテルミサルタンとカルシウム拮抗薬であるアムロジピンを併用している患者の服薬コンプライスの向上を目的に、開発される配合剤の試験となります。 試験開始時期:2007年12月 参加期間:56週間 内容:通院16回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年12月21日に「ミカムロⓇ配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 試験開始までに現在使用している降圧剤を中止し、試験が指定する降圧剤に切り替えることができる方 |
| 募集期限 | 2009年12月17日 |
【高血圧症】降圧剤で治療している方対象の長期通院型試験(関西)
| 問い合わせ番号 | 31 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は、高血圧症の治療薬の試験です。高血圧症以外の合併症のある患者の大部分は目標血圧を達成するために、複数降圧剤を服用しているケースが多いです。本試験は、ARBであるテルミサルタンとカルシウム拮抗薬であるアムロジピンを併用している患者の服薬コンプライスの向上を目的に、開発される配合剤の試験となります。 試験開始時期:2007年12月 参加期間:56週間 内容:通院16回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年12月21日に「ミカムロⓇ配合錠BP」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 試験開始までに現在使用している降圧剤を中止し、試験が指定する降圧剤に切り替えることができる方 |
| 募集期限 | 2009年12月17日 |
【アレルギー性鼻炎】12歳以上の子供から大人まで参加の花粉症試験(関東)
| 問い合わせ番号 | 2627 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬はアレルギー性疾患治療薬です。くしゃみ、鼻水、鼻づまりを引き起こすヒスタミンをブロックする成分と鼻づまりの原因を引き起こす鼻粘膜の血管のふくらみを収縮する成分と異なる2つの成分が含まれた配合薬となります。 アレルギー鼻炎症状の特に鼻づまりに対する効果が期待できるお薬となります。花粉症にひどくお悩みの方はぜひご応募ください。お待ちしております。 試験開始時期2011年1月 参加期間:3週間 内容:通院4回 実施施設:東京都新宿区、東京都小金井橋市 この治験で使用された治験薬は、2012年12月25日に「ディレグラⓇ配合錠」として販売承認されました。 |
| ご協力いただける方 | 12歳以上の男女 スギ花粉の飛散時期にくしゃみ、鼻水、鼻づまりの鼻炎症状がでる方 |
| 募集期限 | 2011年07月17日 |
【アレルギー性鼻炎】12歳以上の子供から大人まで参加の花粉症試験(関西)
| 問い合わせ番号 | 2626 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬はアレルギー性疾患治療薬です。くしゃみ、鼻水、鼻づまりを引き起こすヒスタミンをブロックする成分と鼻づまりの原因を引き起こす鼻粘膜の血管のふくらみを収縮する成分と異なる2つの成分が含まれた配合薬となります。 アレルギー鼻炎症状の特に鼻づまりに対する効果が期待できるお薬となります。花粉症にひどくお悩みの方はぜひご応募ください。お待ちしております。 試験開始時期2011年1月 参加期間:3週間 内容:通院4回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年12月25日に「ディレグラⓇ配合錠」として販売承認されました。 |
| ご協力いただける方 | 12歳以上の男女 スギ花粉の飛散時期にくしゃみ、鼻水、鼻づまりの鼻炎症状がでる方 |
| 募集期限 | 2011年12月17日 |
【健康成人】60名大募集!日本人男性対象宿泊試験(関西)
| 問い合わせ番号 | 2791 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、既に発売されている「リバロ錠」の口腔崩壊錠です。水がなくても簡単に服用ができるため、嚥下能力が低下した患者の方でも服用ができ、服薬コンプライアンスの向上につながると期待されています。60名の方に参加いただきます。是非ご応募お待ちしております。 試験開始時期:2011年7月 内容:2泊3日×2 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年2月15日に「リバロOD錠1mg/2mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の健康な日本人男性 体重が50Kg以上の方 BMI:18.5以上25.0未満 ※BMI=体重(㎏)÷(身長(m))² |
| 募集期限 | 2011年11月17日 |
【健康成人】60名大募集!2泊3日×3回の宿泊試験(関西)
| 問い合わせ番号 | 2843 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、既に発売されている「リバロ錠」の口腔崩壊錠です。水がなくても簡単に服用ができるため、嚥下能力が低下した患者の方でも服用ができ、服薬コンプライアンスの向上につながると期待されています。60名の方に参加いただきます。是非ご応募お待ちしております。 試験開始時期:2011年11月 内容:2泊3日×3 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年2月15日に「リバロOD錠1mg/2mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の健康な日本人男性 体重が50Kg以上の方 BMI:18.5以上25.0未満 ※BMI=体重(㎏)÷(身長(m))² |
| 募集期限 | 2012年02月17日 |
【健康成人】20、30代の健康な日本人男性対象宿泊試験(関西)
| 問い合わせ番号 | 2793 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、既に発売されている「リバロ錠」の口腔崩壊錠です。水がなくても簡単に服用ができるため、嚥下能力が低下した患者の方でも服用ができ、服薬コンプライアンスの向上につながると期待されています。 試験開始時期:2011年7月 内容:2泊3日×2 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年2月15日に「リバロOD錠1mg/2mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の健康な日本人男性 体重が50Kg以上の方 BMI:18.5以上25.0未満 ※BMI=体重(㎏)÷(身長(m))² |
| 募集期限 | 2002年08月01日 |
【インフルエンザ】新型インフルエンザワクチン試験(関西)
| 問い合わせ番号 | -4617 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のインフルエンザワクチンは、新型インフルエンザワクチン(H5N1)です。新型インフルエンザウイルスの出現と大流行(パンデミックス)に備えるために開発しています。ワクチン試験に参加された方には、H5N1型インフルエンザウイルスに対する抗体を獲得することが予想されます。ご応募をお待ちしております。 試験開始時期:2006年9月 参加期間:6ヵ月間 内容:通院7回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年3月25日に「沈降インフルエンザワクチンH5N1「生研」1mL」として販売承認されました。 |
| ご協力いただける方 | 20歳以上65歳未満の日本人男性と日本人女性 BMI:17.5以上26.4未満 ※BMI=体重(kg)÷(身長(m))² |
| 募集期限 | 2007年06月16日 |
【高血圧症】3ヵ月間の短期通院型試験(関東)
| 問い合わせ番号 | 2787 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は高血圧症患者対象の降圧剤です。2種類の異なる降圧剤を1つの錠剤に纏めた配合剤となります。複数の降圧剤を服用されている高血圧症患者にとっては、服用回数も減り、飲み忘れ等も防ぎ、非常にメリットのあるお薬です。 試験開始時期:2011年6月 参加期間:12週間 内容:通院7回 実施施設:東京都新宿区 この治験で使用された治験薬は、2013年6月28日に「イルトラ配合錠LD/同配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳未満 降圧剤で使用し治療している方 又は 降圧剤での治療をしておらず、収縮期血圧(上の血圧値)150以上200未満、かつ拡張期血圧値(下の血圧値)95以上115未満の方 |
| 募集期限 | 2012年03月16日 |
【高血圧症】未治療もしくは既治療の方対象長期投与試験(関東)
| 問い合わせ番号 | 2758 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は高血圧症患者対象の降圧剤です。2種類の異なる降圧剤を1つの錠剤に纏めた配合剤となります。複数の降圧剤を服用されている高血圧症患者にとっては、服用回数も減り、飲み忘れ等も防ぎ、非常にメリットのあるお薬です。 試験開始時期:2011年4月 参加期間:52週間 内容:通院16回 実施施設:東京都新宿区 この治験で使用された治験薬は、2013年6月28日に「イルトラ配合錠LD/同配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳未満の方 本態性高血圧症の診断がある方 未治療もしくは2剤までの降圧剤で治療している方 |
| 募集期限 | 2012年08月15日 |
【高血圧症】3ヵ月間の短期通院型試験(関西)
| 問い合わせ番号 | 2769 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は高血圧症患者対象の降圧剤です。2種類の異なる降圧剤を1つの錠剤に纏めた配合剤となります。複数の降圧剤を服用されている高血圧症患者にとっては、服用回数も減り、飲み忘れ等も防ぎ、非常にメリットのあるお薬です。 試験開始時期:2011年6月 参加期間:12週間 内容:通院7回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2013年6月28日に「イルトラ配合錠LD/同配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳未満 降圧剤で使用し治療している方 又は 降圧剤での治療をしておらず、収縮期血圧(上の血圧値)150以上200未満、かつ拡張期血圧値(下の血圧値)95以上115未満の方 |
| 募集期限 | 2012年03月16日 |
【高血圧症】未治療もしくは既治療の方対象長期投与試験(関西)
| 問い合わせ番号 | 2743 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は高血圧症患者対象の降圧剤です。2種類の異なる降圧剤を1つの錠剤に纏めた配合剤となります。複数の降圧剤を服用されている高血圧症患者にとっては、服用回数も減り、飲み忘れ等も防ぎ、非常にメリットのあるお薬です。 試験開始時期:2011年4月 参加期間:52週間 内容:通院16回 実施施設:大阪府淀川区 この治験で使用された治験薬は、2013年6月28日に「イルトラ配合錠LD/同配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳未満の方 本態性高血圧症の診断がある方 未治療もしくは2剤までの降圧剤で治療している方 |
| 募集期限 | 2012年08月15日 |
【高血圧症】未治療もしくは既治療患者対象(関東)
| 問い合わせ番号 | 2444 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は高血圧症患者対象の降圧剤です。2種類の異なる降圧剤を1つの錠剤に纏めた配合剤となります。複数の降圧剤を服用されている高血圧症患者にとっては、服用回数も減り、飲み忘れ等も防ぎ、非常にメリットのあるお薬です。 試験開始時期:2010年5月 参加期間:12週間 内容:通院7回 実施施設:東京都新宿区 この治験で使用された治験薬は、2013年6月28日に「イルトラ配合錠LD/同配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 25歳以上80歳未満の男女 ※但し女性の場合は閉経後女性のみ 降圧剤のお薬を使用していない方 もしくは 試験開始前に治療で使用している降圧剤を一定期間控えることができる方 |
| 募集期限 | 2010年05月15日 |
【高血圧症】未治療もしくは既治療患者対象(関西)
| 問い合わせ番号 | 2453 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は高血圧症患者対象の降圧剤です。2種類の異なる降圧剤を1つの錠剤に纏めた配合剤となります。複数の降圧剤を服用されている高血圧症患者にとっては、服用回数も減り、飲み忘れ等も防ぎ、非常にメリットのあるお薬です。 試験開始時期:2010年5月 参加期間:12週間 内容:通院7回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2013年6月28日に「イルトラ配合錠LD/同配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 25歳以上80歳未満の男女 ※但し女性の場合は閉経後女性のみ 降圧剤のお薬を使用していない方 もしくは 試験開始前に治療で使用している降圧剤を一定期間控えることができる方 |
| 募集期限 | 2011年03月15日 |
【高血圧症】1年間の長期投与通院試験(関西)
| 問い合わせ番号 | 2539 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 国民の3人のうち1人に当てはまる約4000万人が高血圧症に罹患していると言われています。メタボリックシンドロームの増加傾向に伴い、徐々に高血圧症患者も増加傾向にあります。 今回のお薬は、その高血圧症の治療薬です。高血圧症で使われる経口剤とはことなり、経皮吸収型製剤の降圧薬となります。24時間かけて降圧効果が期待でき、経皮投与による治療手段の拡大に繋がります。 試験開始時期:2010年9月 期間:最大400日 内容:通院20回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2013年6月28日に「ビソノⓇテープ4mg/8mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上80歳以下の日本人高血圧症患者 拡張期血圧値(下の血圧)が90以上の方 |
| 募集期限 | 2012年04月15日 |
【インフルエンザ】ワクチン試験110名大募集(関西)
| 問い合わせ番号 | 2781 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は不活化H5N1トリインフルエンザワクチンです。今回参加される被験者の多くは不活化H5N1トリインフルエンザワクチン接種によって、同ワクチンの株に起因するトリインフルエンザに対して保護されると予想されます。多くのご応募をお待ちしております。 試験開始時期:2011年5月 参加期間:約7ヵ月間 内容:通院4回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年6月18日に「細胞培養インフルエンザワクチンH5N1「バクスター」」として販売承認されました。 |
| ご協力いただける方 | 20歳から59歳までの男女 治験参加前に、インフルエンザワクチンの摂取を受けていない方 |
| 募集期限 | 2012年05月13日 |
【骨粗しょう症】最近背が縮んできたと感じる方対象(関西)
| 問い合わせ番号 | 24 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 骨粗しょう症は、古い骨が壊され、新しい骨がつくられる、所謂、骨の新陳代謝のバランスがくずれ、壊される量が新しくつくられる量を上回り、骨の量がしだいに減り、骨が弱くなり、骨折がおきやすくなった状態をいいます。 今回のお薬は、骨粗しょう症の治療薬で、骨を壊す細胞の働きを抑え、骨の量を増やすことが期待される新しい注射タイプの薬剤です。 試験開始時期:2006年11月 参加期間:3年間 内容:通院37回(月に1回程度) 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年6月28日に「ボンビバ静注1mgシリンジ」として販売承認されました。 |
| ご協力いただける方 | 年齢が60歳以上の方 骨粗しょう症と診断されている方 背中または腰(背骨)に骨折が認められる方 |
| 募集期限 | 2012年03月13日 |
【気管支喘息】吸入ステロイド薬で治療中の方対象(関西)
| 問い合わせ番号 | 189 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は気管支喘息治療薬です。吸入ステロイド剤と気管支拡張剤と異なる2つの有効成分を配合したた加圧噴霧式定量吸入器の製剤となり、ドライパウダー吸入器の使用が困難な患者でも使用することができる新しいタイプのお薬となります。 気管支喘息でお悩みの患者の方は、是非ご応募をお待ちしております。 試験開始時期:2008年11月 参加期間:6週間 内容:通院5回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2013年9月20日に「フルティフォームⓇ50/Ⓡ125エアゾール 56吸入用、同120吸入用」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 治験参加前から吸入ステロイド薬で治療中の方 発作時に気管支拡張剤を使用する方 |
| 募集期限 | 2008年11月13日 |
【インフルエンザ】患者と同居家族が一緒に参加する通院型治験(関西)
| 問い合わせ番号 | 2855 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のワクチンは、A型インフルエンザウィルス感染症とB型インフルエンザウィルス感染症の予防と治療目的に開発されていた吸入タイプの抗インフルエンザ薬です。インフルエンザウィルス感染症患者とその同居家族が一緒に参加する試験です。ご家族でインフルエンザ症状が発現された方がおられましたら、直ぐにご応募下さい。お待ちしております。 試験開始時期:2011年10月 内容:最大4回通院 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年12月20日に「イナビル吸入粉末剤20mg」として販売承認されました。 |
| ご協力いただける方 | 患者 ・インフルエンザウィルスキットで陽性と診断された方 ・同居家族の中で一番最初にA型又はB型インフルエンザウィルス感染症に罹患した方 同居家族 ・A型又はB型インフルエンザウィルス感染症に罹患していない方 ・体温が36.9℃以下の方 |
| 募集期限 | 2012年06月13日 |
【インフルエンザ】健康成人男性対象の宿泊試験(関西)
| 問い合わせ番号 | 2688 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のワクチンは、A型インフルエンザウィルス感染症とB型インフルエンザウィルス感染症の予防と治療目的に開発されていた吸入タイプの抗インフルエンザ薬です。5名を一つのグループとし、合計35名の方に参加いただく試験です。ご応募お待ちしております。 試験開始時期:2011年3月 内容:①2泊3日+通院1回 ②3泊4日+通院1回 ③4泊5日+通院1回 ④1泊2日+2泊3日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年12月20日に「イナビル吸入粉末剤20mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から45歳までの健康な日本人男性 これまでに喫煙歴がない方 |
| 募集期限 | 2011年03月13日 |
【健康成人】12泊13日の長期入院試験(関西)
| 問い合わせ番号 | 2748 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は既に透析患者に使用されている薬剤の用量を半量にした場合の効果を比較するための試験です。 試験開始時期:2011年4月 内容:12泊13日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年1月17日に「リオナ錠Ⓡ250mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から35歳までの健康な日本人男性 BMIの数値18.5以上24.9以下の方 |
| 募集期限 | 2011年07月10日 |
【アレルギー性結膜炎】子供から大人まで参加の通院試験(関西)
| 問い合わせ番号 | 2773 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回はアレルギー性結膜炎の症状がある方に参加いただく目薬の治験のご案内です。 春頃になると眼に痒みが出てくる方や季節に関係なく眼の痒みが出る方は必見です。特に今回はお子さんも参加可能です。アレルギー症状は年齢が若いほど症状がでやすいため、親子で参加はいかがでしょうか。ご応募をお待ちしております。 試験開始時期:2011年6月 参加期間:8週間 内容:通院6回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年9月30日に「アレジオン点眼液0.05%」として販売承認されました。 |
| ご協力いただける方 | 12歳以上の男女 何かしらのアレルギーが原因で眼の痒みの症状がある方 |
| 募集期限 | 2012年08月10日 |
【アレルギー性結膜炎】子供から大人まで参加の通院試験(関東)
| 問い合わせ番号 | 2766 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回はアレルギー性結膜炎の症状がある方に参加いただく目薬の治験のご案内です。 春頃になると眼に痒みが出てくる方や季節に関係なく眼の痒みが出る方は必見です。特に今回はお子さんも参加可能です。アレルギー症状は年齢が若いほど症状がでやすいため、親子で参加はいかがでしょうか。ご応募をお待ちしております。 試験開始時期:2011年6月 参加期間:8週間 内容:通院6回 実施施設:東京都新宿区 この治験で使用された治験薬は、2013年9月30日に「アレジオン点眼液0.05%」として販売承認されました。 |
| ご協力いただける方 | 12歳以上の男女 何かしらのアレルギーが原因で眼の痒みの症状がある方 |
| 募集期限 | 2012年08月10日 |
【高リン血症】腹膜透析患者対象試験(関西)
| 問い合わせ番号 | 4748 |
|---|---|
| 実施地区 | |
| 説明 | 腎機能が低下すると尿の生成が低下する事で、リンが尿中に排泄されず、体内にリンが蓄積します。これが高リン血症がおこるる要因です。リンが蓄積した状態を放置しておくと、リンとカルシウムが結合して血管石灰化がおこります。また副甲状腺ホルモンの過剰分泌がおこり、骨がもろくなり、骨折をおこしやすくなるなどの症状がでてきます。 試験開始時期:2013年3月 参加期間:28週間 内容:通院15回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2015年9月28日に「ピートルⓇチュワブル錠」として販売承認されました。 |
| ご協力いただける方 | 慢性腎不全と診断され腹膜透析を受けている方 高リン血症の治療薬で治療されている方 |
| 募集期限 | 2014年09月10日 |
【糖尿病】2013年11月スタート 通院試験(関西)
| 問い合わせ番号 | 3201 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2013年11月 参加期間:グループ1:約1年間 グループ2:約6ヶ月間 内容:グループ1:通院17回程度 グループ2:通院10回程度 実施施設:大阪府吹田市 この治験で使用された治験薬は、2016年12月19日に「リキスミア皮下注300μg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳以下(男女不問)の方で、以下のいずれかに該当する方 ①糖尿病治療薬の使用がなく(運動療法・食事療法のみ)、 ヘモグロビンA1c(HbA1c)が7.0%以上9.5%未満 ②1種類の糖尿病治療薬を服用しており、 ヘモグロビンA1c(HbA1c)7.0%以上9.5%未満 (少なくとも1週間以上服用を中止してから検査を実施します) |
| 募集期限 | 2014年09月30日 |
【糖尿病】10月に始まる長期通院試験(関西)
| 問い合わせ番号 | 3500 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2014年10月 参加期間:約9ヵ月間 内容:通院13回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2018年3月23日に「オゼンピック皮下注2mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)で、以下の条件にいづれかに該当する方 ①運動療法・食事療法のみで血糖コントロールを行っており、 ヘモグロビンA1c(HbA1c:NGSP)が7.0%以上10.5%以下 ②糖尿病治療薬1種類で血糖コントロールを行っており、 ヘモグロビンA1c(HbA1c:NGSP)が6.5%以上9.5%以下 |
| 募集期限 | 2015年03月31日 |
【副甲状腺機能亢進症】血液透析施行中の患者対象(関西)
| 問い合わせ番号 | 4732 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 血液透析施行中の二次性副甲状腺機能亢進症患者を対象に1日1回3週間投与した際の有効性及び安全性を検証する内容です。 試験開始時期:2014年7月 参加期間:29日間 内容:通院12回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2018年3月23日に「オルケディア錠1mg、2mg」として販売承認されました。 |
| ご協力いただける方 | 同意取得年齢が20歳以上75歳未満の方 週3回の血液透析を受ける慢性腎不全患者 |
| 募集期限 | 2015年06月13日 |
【アトピー性皮膚炎】女性限定、肌測定の試験モニター(関東)
| 問い合わせ番号 | 4663 |
|---|---|
| 実施地区 | |
| 説明 | アトピー性皮膚炎の方を対象に、アトピー症状の程度、皮膚の水分量、バリア機能などの肌測定を行います。 アトピー症状の程度、皮膚の水分量、バリア機能などの測定を行うモニター試験となりますのでお薬などの服用はありません。 参加開始時期:2019年12月 参加期間:1ヵ月間 内容:通院1回 |
| ご協力いただける方 | ・関東在住の方 ・同意取得時の年齢が30歳以上49歳以下の女性 ・アトピー性皮膚炎の症状が現在ある方 (来所当日に症状があることが必須です。) ・アトピー性皮膚炎の症状がある部位の写真をアップロード可能な方 ※ご自身のスマホで撮影後、指定のWebページにてアップロード |
| 募集期限 | 2019年12月16日 |
【美容モニター】ニキビでお悩みの方対象の通院試験モニター(関東)
| 問い合わせ番号 | 4682 |
|---|---|
| 実施地区 | |
| 説明 | ニキビでお悩みの方対象に拭き取りシートを8週間使用した際の改善効果を検証する美容モニターです。 |
| ご協力いただける方 | ・関東地区在住の方 ・年齢20~39歳までの日本人男性及び女性 ・左右どちらかの片顔において、炎症性皮疹(ニキビ)が6個以上20個以下ある方 |
| 募集期限 | 2020年01月20日 |
【医療機器モニター】心不全の方対象の試験モニター(関西)
| 問い合わせ番号 | 4716 |
|---|---|
| 実施地区 | |
| 説明 | これまでに「急性心不全」「心筋梗塞」「不安定狭心症」のいずれかの症状で入院治療の経験がある方を対象に実施する医療機器測定モニター試験のご案内です。 試験開始時期:2020年2月 内容:通院1回 実施施設:京都府 |
| ご協力いただける方 | ・同意取得時において年齢が20歳以上の者 ・急性心不全、心筋梗塞、不安定狭心症のいずれかで入院したことがある方 ・過去3か月間に入院歴がない方 ・関西在住の方 |
| 募集期限 | 2020年02月13日 |
【美容モニター】男性型脱毛症の方対象の試験モニターのご案内(関東)
| 問い合わせ番号 | 4660 |
|---|---|
| 実施地区 | |
| 説明 | 男性型脱毛症が気になる方で、緒方の分類でⅡ又はⅣの初期~末期に該当する方にご協力いただきます。 育毛剤の塗布による育毛効果を評価するためにマイクロスコープによる局所毛髪処理部位の撮影、頭部デジタル写真撮影、専門家による洗髪、自覚症状アンケートを行います。 参加開始時期:2019年12月 参加期間:8ヵ月間 内容:通院10回 |
| ご協力いただける方 | ・関東地区在住 ・同意取得時の年齢が20歳以上60歳以下の日本人男性 ・男性型脱毛症が気になる方 ・緒方の分類でⅡ又はⅣの初期~末期に該当する方 ・頭頂部に約1.5㎝×約1.5㎝(約2平方センチメートル領域で約1mmの長さ)の局所毛髪処理に同意可能な方 |
| 募集期限 | 2019年12月20日 |
【健康成人】大募集中!!GWを利用しての3泊4日2回セット(関西)
| 問い合わせ番号 | 3845 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2016年3月 内容:3泊4日2回セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2017年8月15日に「オルメサルタン錠5mg「ニプロ」・オルメサルタン錠10mg「ニプロ」・オルメサルタン錠20mg「ニプロ」・オルメサルタン錠40mg「ニプロ」」として販売承認されました。 |
| ご協力いただける方 | ・20歳から35歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 ※まだまだ枠に余裕があります。 |
| 募集期限 | 2016年04月24日 |
【健康成人】大募集中!!GWを利用しての3泊4日2回セット(関西)
| 問い合わせ番号 | 3844 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2016年3月 内容:3泊4日×2回セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2017年8月15日に「オルメサルタン錠5mg「ニプロ」・オルメサルタン錠10mg「ニプロ」・オルメサルタン錠20mg「ニプロ」・オルメサルタン錠40mg「ニプロ」」として販売承認されました。 |
| ご協力いただける方 | ・20歳から35歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 ※まだまだ枠に余裕があります。 |
| 募集期限 | 2016年04月23日 |
【インフルエンザ】インフルエンザウイルス感染症患者対象(関西)
| 問い合わせ番号 | 3766 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | インフルエンザウイルス感染症患者を対象に指定する異なる薬剤を投与し、有効性を評価する内容です。 参加開始時期:2015年11月 内容:発症後7回通院 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年2月23日に「ゾフルーザ錠10mg・ゾフルーザ錠20mg」として販売承認されました。 |
| ご協力いただける方 | ・同意取得時に20歳以上65歳未満の男女 ・インフルエンザウイルス感染症と診断せれている方 ・発症から48時間までの方 ・38℃以上の発熱がある方 |
| 募集期限 | 2016年06月01日 |
【花粉症】スギ花粉による鼻炎症状のある方(関西)
| 問い合わせ番号 | 3698 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2016年2月 参加期間:約2週間 内容:通院4回程度 実施施設:大阪府吹田市 この治験で使用された治験薬は、2018年1月19日に「アレサガテープ4mg・アレサガテープ8mg」として販売承認されました。 |
| ご協力いただける方 | 年齢16歳以上65歳未満(男女不問)で、以下の条件に該当する方 ※但し、未成年については、必ず親権者と一緒に通院できる方のみ参加可 ①2年以上前からスギ花粉飛散時期に鼻炎症状(鼻づまり、鼻水、くしゃみ)がある方 ②一定期間(治験開始1週間前から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 |
| 募集期限 | 2016年03月20日 |
【健康成人】遠方の方におすすめ!入院のみの試験!4泊5日2回セット
| 問い合わせ番号 | 3678 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2015年9月 内容:4泊5日2回セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2017年2月15日に「 テルミサルタン錠20mg「ニプロ」・テルミサルタン錠40mg「ニプロ」・テルミサルタン錠80mg「ニプロ」」として販売承認されました。 |
| ご協力いただける方 | ・20歳から35歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2015年10月09日 |
39歳の方まで参加可【8/18(火)入院開始試験】4泊5日3回セット
| 問い合わせ番号 | 3641 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2015年8月 内容:4泊5日×3回セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年2月23日に「ゾフルーザ錠10mg・ゾフルーザ錠20mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳から39歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2015年08月16日 |
【アレルギー性鼻炎】季節問わず鼻炎症状のある方対象(関西)
| 問い合わせ番号 | 3634 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2015年8月 参加期間:12週間(最大52週間まで期間延長) 内容:通院6回(最大16回) 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年1月19日に「アレサガテープ4mg・アレサガテープ8mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳以下(男女不問)の方、以下の条件に該当する方 ①2年以上前から季節問わず年間通じて鼻炎症状のある方 ②一定期間(治験開始から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 |
| 募集期限 | 2017年04月30日 |
【アレルギー性鼻炎】季節問わず鼻炎症状のある方対象(関東)
| 問い合わせ番号 | 3607 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2015年8月 参加期間:12週間(最大52週間まで期間延長) 内容:通院6回(最大16回) 実施施設、東京都新宿区、東京都小金井橋市 この治験で使用された治験薬は、2018年1月19日に「アレサガテープ4mg・アレサガテープ8mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳以下(男女不問)の方、以下の条件に該当する方 ①2年以上前から季節問わず年間通じて鼻炎症状のある方 ②一定期間(治験開始から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 |
| 募集期限 | 2015年10月31日 |
【39歳の方まで参加できる4月実施の宿泊試験 その①】4泊5日+通院2回
| 問い合わせ番号 | 3581 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2015年4月 内容:4泊5日+通院2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年2月23日に「ゾフルーザ錠10mg・ゾフルーザ錠20mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳から39歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2015年04月12日 |
【脂質異常症】未治療もしくは1種類服薬中の方へ(関西)
| 問い合わせ番号 | 3556 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2015年10月 参加期間:約8ヵ月間(32週間) 内容:通院6回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年9月27日に「アトーゼットTM配合錠LD,アトーゼットTM配合錠HD」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で、以下の全ての条件に該当する方 ①脂質低下薬の服薬していないもしくは脂質低下薬を1種類服薬している方 ②LDL-C(コレステロール)値が120㎎dL以上の方 |
| 募集期限 | 2016年02月29日 |
【健康成人】ワクチン試験(関西)
| 問い合わせ番号 | 3521 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2014年11月 参加期間:1ヶ月間 内容:通院2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年2月29日に「トリビック」として販売承認されました。 |
| ご協力いただける方 | 年齢が20歳以上65歳未満の健康成人男女 被験者本人から文書による同意が得られた方 |
| 募集期限 | 2014年11月21日 |
【11月実施の長期宿泊試験】6泊7日のみ(関西)
| 問い合わせ番号 | 3508 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2014年11月 内容:6泊7日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳から35歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2014年11月26日 |
【アレルギー性鼻炎】大募集!! 今年夏より実施 短期通院試験(関西)
| 問い合わせ番号 | 3324 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2014年8月 参加期間:約1ヵ月半(6~7週間) 内容:通院5回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2016年9月28日に「ビラノア錠20mg」として販売承認されました。 |
| ご協力いただける方 | 年齢18歳以上64歳以下(男女不問)の方で、以下の条件に該当する方 ※未成年の方は保護者と一緒に通院できる方が参加条件となります ①季節を問わず年中鼻炎症状(鼻づまり、鼻水、くしゃみ)がある方 ②一定期間(治験開始2週間前から終了まで)、治験薬以外の鼻炎治療薬など 治験薬の評価に影響がある薬剤について、使用を制限できる方 ③女性の場合は、閉経している方もしくは適切な避妊を実施いただける方 |
| 募集期限 | 2014年12月27日 |
【アレルギー性鼻炎】大募集!! 今年夏より実施 短期通院試験(関西)
| 問い合わせ番号 | 3463 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2014年8月 参加期間:約1ヵ月半(6~7週間) 内容:通院5回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年9月28日に「ビラノア錠20mg」として販売承認されました。 |
| ご協力いただける方 | 年齢18歳以上64歳以下(男女不問)の方で、以下の条件に該当する方 ※未成年の方は保護者と一緒に通院できる方が参加条件となります ①季節を問わず年中鼻炎症状(鼻づまり、鼻水、くしゃみ)がある方 ②一定期間(治験開始2週間前から終了まで)、治験薬以外の鼻炎治療薬など 治験薬の評価に影響がある薬剤について、使用を制限できる方 ③女性の場合は、閉経している方もしくは適切な避妊を実施いただける方 |
| 募集期限 | 2015年01月04日 |
【健康成人】14泊15日の長期入院型治験(関西)
| 問い合わせ番号 | 3440 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験参加時期:2014年6月 内容:14泊15日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年7月4日に「エピデュオゲル」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の健康な成人男性 治験実施計画書の規定を遵守する意思のある方 |
| 募集期限 | 2014年06月09日 |
【スギ花粉症】関東地区限定!初夏から開始 長期通院試験
| 問い合わせ番号 | 3438 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2014年7月 参加期間:3年間 内容:通院26回 実施施設:東京都新宿区 この治験で使用された治験薬は、2017年9月27日に「シダキュア®スギ花粉症舌下錠2000JAU・シダキュア®スギ花粉症舌下錠5000JAU」として販売承認されました。 |
| ご協力いただける方 | 年齢12歳以上64歳以下(男女不問)の方で、以下の条件に該当する方 ①スギ花粉の飛散時期(2.3.4月)にくしゃみ、鼻汁、鼻閉のいずれかの鼻症状がある方 ②一定期間(治験開始2週間前から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 |
| 募集期限 | 2014年09月01日 |
【脂質異常症】夏から始まる中性脂肪が高い方対象(関東)
| 問い合わせ番号 | 3420 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加参加時期:2014年7月 参加期間:8ヵ月間 内容:通院9回 実施施設:東京都新宿区 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳未満(男女不問)の方で、以下の条件全てに該当する方 ①治験開始の少なくとも4週間以上前から食事療法または運動療法を実施している方 ②中性脂肪(TG値) が150㎎/dL以上 ③女性は閉経後 |
| 募集期限 | 2014年09月30日 |
【糖尿病】8月に始まる長期通院試験(関東)
| 問い合わせ番号 | 3415 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2014年8月 参加期間:約15ヵ月間 内容:通院12回 実施施設:東京都新宿区 この治験で使用された治験薬は、2018年3月23日に「オゼンピック皮下注2mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)で、以下の条件に該当する方 運動療法・食事療法のみで血糖コントロールを行っており、 ヘモグロビンA1c(HbA1c:NGSP)が7.0%以上10.5%以下 |
| 募集期限 | 2014年12月31日 |
【糖尿病】10月に始まる長期通院試験(関東)
| 問い合わせ番号 | 3414 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2014年10月 参加期間:約9ヵ月間 内容:通院13回 実施施設:東京都新宿区 この治験で使用された治験薬は、2018年3月23日に「オゼンピック皮下注2mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)で、以下の条件にいづれかに該当する方 ①運動療法・食事療法のみで血糖コントロールを行っており、 ヘモグロビンA1c(HbA1c:NGSP)が7.0%以上10.5%以下 ②糖尿病治療薬1種類で血糖コントロールを行っており、 ヘモグロビンA1c(HbA1c:NGSP)が6.5%以上9.5%以下 |
| 募集期限 | 2016年04月30日 |
【脂質異常症】夏から始まる中性脂肪が高い方対象(関西)
| 問い合わせ番号 | 3407 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加参加時期:2014年7月 参加期間:8ヵ月間 内容:通院9回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳未満(男女不問)の方で、以下の条件全てに該当する方 ①治験開始の少なくとも4週間以上前から食事療法または運動療法を実施している方 ②中性脂肪(TG値) が150㎎/dL以上 ③女性は閉経後 |
| 募集期限 | 2014年10月31日 |
【4月治験で最大の定員数!】 4泊5日のみ
| 問い合わせ番号 | 3396 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験参加時期:2014年3月 内容:4泊5日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年2月15日に「トミロン細粒20%」として販売承認されました。 |
| ご協力いただける方 | 20歳から39歳までの健康な日本人男性 BMI:18.5以上24.9以下の方 関西圏にお住まいの方 健康診断の結果より参加可能で、かつ定められた宿泊日程と通院日程に来院できる方 |
| 募集期限 | 2014年04月04日 |
【3月末スタート治験!】 3泊4日×2回+通院1回(関西)
| 問い合わせ番号 | 3385 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2014年3月 内容:3泊4日2回セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年9月23日に「オキシコドン徐放錠:5mg・10mg・20mg・40mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から39歳までの健康な日本人男性 BMI:18.5以上24.9以下の方 関西圏にお住まいの方 健康診断の結果より参加可能で、かつ定められた宿泊日程と通院日程に来院できる方 |
| 募集期限 | 2014年03月28日 |
【インフルエンザワクチン】50名に参加頂くインフルエンザワクチン治験(関西)
| 問い合わせ番号 | 3352 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のワクチンは、季節性インフルエンザワクチンです。1週間~4週間の間隔で、2回接種となります。 募集が殺到する、2ヵ月間で3回だけ通院するワクチン試験のご案内です。 多くのご応募をお待ちしております。 試験開始時期:2014年3月 参加期間:2ヵ月間 内容:通院3回 参加施設:大阪市淀川区 この治験で使用された治験薬は、2015年5月25日に「インフルエンザHAワクチン「生研」」として販売承認されました。 |
| ご協力いただける方 | 20歳から64歳までの男性と女性 通院治療されている症状が無い方 |
| 募集期限 | 2014年03月30日 |
【インフルエンザワクチン】応募が殺到する短期通院型試験(関西)
| 問い合わせ番号 | 3351 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のワクチンは、季節性インフルエンザワクチンです。1週間~4週間の間隔で、2回接種となります。 募集が殺到する、2ヵ月間で3回だけ通院するワクチン試験のご案内です。今回は55名に参加いただきます。 多くのご応募をお待ちしております。 試験開始時期:2014年3月 参加期間:2ヵ月間 内容:通院3回 参加施設:大阪市淀川区 この治験で使用された治験薬は、2015年5月25日に「ビケンHA」」として販売承認されました。 |
| ご協力いただける方 | 20歳から64歳までの男性と女性 通院治療されている症状が無い方 |
| 募集期限 | 2014年03月29日 |
【脂質異常症】治療中の方対象 通院タイプの試験(関東)
| 問い合わせ番号 | 3337 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 試験開始時期:2014年3月 参加期間:約15ヵ月間(62週間) 内容:通院26~30回程度 実施施設:東京都新宿区 この治験で使用された治験薬は、2016年7月4日に「プラルエント®皮下注75mgペン、150mgペン/75mgシリンジ、150mgシリンジ」として販売承認されました。 |
| ご協力いただける方 | 脂質低下薬を服用しているにも関わらずLDLコレステロール値 が 120㎎/dL以上の方で以下のいずれかの条件に該当する方 ①年齢20歳以上(男女不問)で、糖尿病を合併している ②年齢50歳以上(男女不問)で、蛋白尿がみとめられる |
| 募集期限 | 2014年07月31日 |
【脂質異常症】治療中の方対象 通院タイプの試験(関西)
| 問い合わせ番号 | 3321 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2014年3月 参加期間:約15ヵ月間(62週間) 内容:通院26~30回程度 実施施設:大阪府吹田市 この治験で使用された治験薬は、2016年7月4日に「プラルエント®皮下注75mgペン、150mgペン/75mgシリンジ、150mgシリンジ」として販売承認されました。 |
| ご協力いただける方 | 脂質低下薬を服用しているにも関わらずLDLコレステロール値 が 120㎎/dL以上の方で以下のいずれかの条件に該当する方 ①年齢20歳以上(男女不問)で、糖尿病を合併している ②年齢50歳以上(男女不問)で、蛋白尿がみとめられる |
| 募集期限 | 2014年06月01日 |
【糖尿病】2型糖尿病患者対象の入院試験(関東)
| 問い合わせ番号 | 3308 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 糖尿病治療薬による治療を受けていない方や、血糖コントロールが不十分な日本人2型糖尿病患者を対象に4週間投与した時の有効性を検討する内容です。 試験参加時期:2013年9月 参加期間:最大9週間 内容:3泊4日+2泊3日+通院4回 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 同意取得前に2型糖尿病と診断されている方 同意取得前12週間,食事療法及び運動療法を実施中で、糖尿病治療薬による治療を受けていない方 スルホニル尿素薬及びチアゾリジン薬以外の経口血糖降下薬1剤による治療を受けており,同意取得前12週以内に用法・用量の変更がない方 Visit 1(スクリーニング)でのHbA1c が次の基準を満たす方 1) 糖尿病治療薬による治療を受けていない患者:HbA1c が7.0%以上かつ10.0%以下 2) 経口血糖降下薬1 剤による治療を受けていた患者:HbA1c が7.0%以上かつ9.5%以下 同意取得時の年齢が20歳以上かつ74歳以下の患者 |
| 募集期限 | 2014年01月31日 |
【健康成人】12月スタート 4泊5日×2回(関西)
| 問い合わせ番号 | 3300 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験参加時期:2013年10月 内容:4泊5日2回セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年9月28日に「イニシンク®配合錠」として販売承認されました。 |
| ご協力いただける方 | 20歳から35歳までの健康な日本人男性 体重50kg以上の方 BMI:18.5以上25.0以下の方 関西圏にお住まいの方 健康診断の結果より参加可能で、かつ定められた宿泊日程と通院日程に来院できる方 |
| 募集期限 | 2013年11月30日 |
【糖尿病】2型糖尿病患者対象の入院試験(関西)
| 問い合わせ番号 | 3297 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 糖尿病治療薬による治療を受けていない方や、血糖コントロールが不十分な日本人2型糖尿病患者を対象に4週間投与した時の有効性を検討する内容です。 試験参加時期:2013年9月 参加期間:最大9週間 内容:3泊4日+2泊3日+通院4回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 同意取得前に2型糖尿病と診断されている方 同意取得前12週間,食事療法及び運動療法を実施中で、糖尿病治療薬による治療を受けていない方 スルホニル尿素薬及びチアゾリジン薬以外の経口血糖降下薬1剤による治療を受けており,同意取得前12週以内に用法・用量の変更がない方 Visit 1(スクリーニング)でのHbA1c が次の基準を満たす方 1) 糖尿病治療薬による治療を受けていない患者:HbA1c が7.0%以上かつ10.0%以下 2) 経口血糖降下薬1 剤による治療を受けていた患者:HbA1c が7.0%以上かつ9.5%以下 同意取得時の年齢が20歳以上かつ74歳以下の患者 |
| 募集期限 | 2013年10月31日 |
【脂質異常症】宿泊試験です。中性脂肪が高めの方が対象(関西)
| 問い合わせ番号 | 3288 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2013年11月 参加期間:約3ヵ月間 日程:通院2回程度+2泊3日×3回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上64歳以下(男女不問)の方で、以下の条件全てに該当する方 ①治験開始前から一定の食事療法または一定の食事・運動療法を実施している方 ②中性脂肪が150㎎/dL以上でHDLコレステロールが低い※方 ※男性:50㎎/dL未満、女性:55㎎/dL未満程度 ③女性の場合は閉経後の方 |
| 募集期限 | 2014年06月23日 |
【糖尿病】2014年1月に始まる通院試験(関東)
| 問い合わせ番号 | 3287 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2014年2月 参加期間:約9ヵ月間 内容:通院9回 実施施設:東京都新宿区 この治験で使用された治験薬は、2018年3月23日に「オゼンピック皮下注2mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)で、以下の条件に該当する方 運動療法・食事療法のみで血糖コントロールを行っており、 ヘモグロビンA1c(HbA1c:NGSP)が7.0%以上10.0%以下 |
| 募集期限 | 2014年03月01日 |
【糖尿病】2013年10月スタート 長期通院試験
| 問い合わせ番号 | 3285 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 試験開始時期:2013年10月 参加期間:約12ヵ月間 内容:通院16回程度 実施施設:東京都新宿区 この治験で使用された治験薬は、2016年12月19日に「リキスミア皮下注300μg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳以下(男女不問)の方で、以下の条件全てに該当する方 ①1年以上前から2型糖尿病と診断されている方 ②1種類の糖尿病治療薬を服用しており、 ヘモグロビンA1c(HbA1c)7.0%以上9.5%未満 |
| 募集期限 | 2014年06月30日 |
【通年性アレルギー性鼻炎】夏から冬にかけて実施予定(関西)
| 問い合わせ番号 | 3269 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2013年7月 参加期間:約1ヵ月間 内容:通院5回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年9月28日に「デザレックス錠5㎎」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で以下の条件に該当する方 ①季節を問わず年中鼻炎症状(くしゃみ、鼻水、鼻づまり)がある方 ②一定期間(治験開始4週間前から終了まで)、治験薬以外の鼻炎の治療薬など(治験薬の評価に影響がある薬剤)の使用を制限できる方 ③女性の場合は、閉経している方もしくは適切な避妊を実施いただける方 |
| 募集期限 | 2014年01月01日 |
【通年性アレルギー性鼻炎】夏から冬にかけて実施予定(関東)
| 問い合わせ番号 | 3241 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 試験開始時期:2013年7月 参加期間:約1ヵ月間 内容:通院5回 実施施設:東京都新宿区 この治験で使用された治験薬は、2016年9月28日に「デザレックス錠5㎎」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で以下の条件に該当する方 ①季節を問わず年中鼻炎症状(くしゃみ、鼻水、鼻づまり)がある方 ②一定期間(治験開始4週間前から終了まで)、治験薬以外の鼻炎の治療薬など(治験薬の評価に影響がある薬剤)の使用を制限できる方 ③女性の場合は、閉経している方もしくは適切な避妊を実施いただける方 |
| 募集期限 | 2014年05月05日 |
【脂質異常症】中性脂肪が高めの方を対象に実施
| 問い合わせ番号 | 3205 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2014年春頃(随時募集中) 参加期間:12ヵ月間程度 通院回数:14回程度 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)の方で、以下の条件全てに該当する方 ①治験開始の少なくとも4週間以上前から食事療法または運動療法を実施している方 ②中性脂肪が200㎎/dL以上の方 ③女性の場合は閉経後の方 |
| 募集期限 | 2014年07月31日 |
【高血圧症】 未治療の高血圧患者対象の短期通院試験(関西)
| 問い合わせ番号 | 3202 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加期間:約4ヵ月間 内容:通院6回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2016年9月28日に「ミカトリオ®配合錠」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上73歳以下(男女不問)の方で、以下のいずれかに該当する方 ①未治療で収縮期血圧が150㎜Hg以上かつ拡張期血圧が100㎜Hg以上の方 ②2種類までの降圧剤を服用中で、拡張期血圧が100㎜Hg以上の方 ③3種類の降圧剤を服用中で、拡張期血圧が85㎜Hg以上の方 |
| 募集期限 | 2014年11月30日 |
【糖尿病】長期通院試験 大募集!!(関西)
| 問い合わせ番号 | 3200 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2013年9月 参加期間:約12ヵ月間 内容:通院17回 実施施設:大阪府吹田市 ※この治験で使用された治験薬は、2016年12月19日に「リキスミア皮下注300μg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上75歳以下(男女不問)の方で以下の条件全てに該当する方 ①1年以上前に2型糖尿病と診断された方 ②糖尿病治療薬を1種類のみ服用しており、ヘモグロビンA1c(HbA1c)が7.0%以上9.5%未満 |
| 募集期限 | 2014年06月30日 |
【脂質異常症】1剤で治療中の方対象通院試験(関西)
| 問い合わせ番号 | 3188 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2013年3月 参加期間:約6ヵ月間(26週間) 内容:通院10回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2016年7月4日に「プラルエント®皮下注75mgペン、150mgペン/75mgシリンジ、150mgシリンジ」として販売承認されました。 |
| ご協力いただける方 | ・指定する1剤の治療薬で一定用量を投与されている原発性高コレステロール血症患者でかつ、LDLコレステロールの数値が100㎎/dL以上の方 ・20歳以上75歳以下 ・BMI:18.0以上40.0未満 |
| 募集期限 | 2013年07月31日 |
3月上旬に始まるロング長期試験3泊4日×3回+通院12回(関西)
| 問い合わせ番号 | 3178 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は嚥下困難な方にとっては、錠剤やカプセル剤では飲みづらいという問題点があるため、水なしで口腔内で溶かし、服用することができるため、服用する方の利便性の向上につながることが期待されています。 試験開始時期:2013年1月 内容:3泊4日×3回+通院12回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2015年2月16日に「エックスフォージ配合OD錠」として販売承認されました。 |
| ご協力いただける方 | ◎20歳から40歳までの健康な日本男性 ◎体重50kg以上の方 ◎BMI:18.5以上25.0以下の方 ◎関西圏にお住まいの方 ◎健康診断の結果より参加可能で、かつ定められた宿泊日程と通院日程に来院できる方 |
| 募集期限 | 2013年01月27日 |
【健康成人】2泊3日×2+通院1回の試験(関西)
| 問い合わせ番号 | 3160 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験参加時期:2012年12月 内容:2泊3日2回セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年8月8日に「グロウジェクト®皮下注6mg/12mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から35歳までの健康な日本人男性 関西圏にお住まいの方 BMI:18.5以上24.9以下の方 体重50kg以上の方 健康診断の結果より参加可能で、かつ定められた宿泊日程と通院日程に来院できる方 |
| 募集期限 | 2013年05月01日 |
【糖尿病】インスリンで治療中の患者対象(関西)
| 問い合わせ番号 | 3158 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | インスリン グラルギンと経口糖尿病薬で十分な血糖コントロールが得られていない2型糖尿病患者を対象として、本試験の指定するインスリン注射剤を26週間投与し、有効性と安全性を検証する内容です。 試験参加時期:2013年5月 参加期間:7ヵ月間 内容:通院11回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2016年9月28日に「①トレシーバ注 フレックスタッチ、②トレシーバ注 ペンフィル」として販売承認されました。 |
| ご協力いただける方 | ・年齢20歳以上 ・インスリングラルギンと経口糖尿病薬による治療を受けている患者 ・HbA1c:7.0%以上、9.5%以下 ・体容量指数(BMI):35 kg/m2以下 |
| 募集期限 | 2013年07月31日 |
【糖尿病】食事/運動療法に加え1剤の治療薬で治療中の方対象(関東)
| 問い合わせ番号 | 3074 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 本治験では、20歳以上の食事/運動療法に加え経口糖尿病治療薬単剤治療で十分な血糖コントロールが得られない日本人2型糖尿病患者で有効性や安全性を検証するし内容です。 試験開始時期:2012年8月 参加期間:最大62週間(観察期:最大8週間、治療期:52週間) 内容:通院15回 実施施設:東京都新宿区 この治験で使用された治験薬は、2015年9月28日に「マリゼブⓇ錠12.5mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者の方 同意取得時の年齢が20歳以上の方 HbA1cが6.5%以上10.0%以下 BMIが18㎏/㎡以上40㎏/㎡以下 |
| 募集期限 | 2014年09月26日 |
【健康成人】2泊3日×2回の短期投与試験(関西)
| 問い合わせ番号 | 3070 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2012年10月 内容:2泊3日×2回+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2015年9月28日に「エクメット®配合錠」として販売承認されました。 |
| ご協力いただける方 | 20~45 歳の健康な男性 体重が50 kg 以上の方 BMIが18 kg/m2 以上,25 kg/m2 以下の方 |
| 募集期限 | 2012年12月18日 |
【健康成人】2泊3日の短期投与試験(関西)
| 問い合わせ番号 | 3066 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2012年10月 内容:2泊3日×2回+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2015年9月28日に「エクメット®配合錠」として販売承認されました。 |
| ご協力いただける方 | 20~45 歳の健康な男性 体重が50 kg 以上の方 BMIが18 kg/m2 以上,25 kg/m2 以下の方 |
| 募集期限 | 2012年12月13日 |
【糖尿病】食事/運動療法に加え1剤の治療薬で治療中の方対象(関西)
| 問い合わせ番号 | 3051 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 本治験では、20歳以上の食事/運動療法に加え経口糖尿病治療薬単剤治療で十分な血糖コントロールが得られない日本人2型糖尿病患者で有効性や安全性を検証するし内容です。 試験開始時期:2012年8月 参加期間:最大62週間(観察期:最大8週間、治療期:52週間) 内容:通院15回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2015年9月28日に「マリゼブⓇ錠12.5mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者の方 同意取得時の年齢が20歳以上の方 HbA1cが6.5%以上10.0%以下 BMIが18㎏/㎡以上40㎏/㎡以下 |
| 募集期限 | 2014年09月26日 |
【糖尿病】1剤で治療中かつ食事・運動療法を実施している方が対象(関西)
| 問い合わせ番号 | 3022 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回の治験は、運動と食事療法に加え、糖尿病治療薬(DPP-4阻害剤)を投与している方を対象に、最大15週間に8回通院いただく試験です。 今回のお薬は、他の糖尿病治療薬と異なり、インスリン分泌を促進する働きや膵臓の保護作用を特徴とし、かつ週1回の投与で効果が期待されています。ご応募をお待ちしております。 試験開始時期:2012年12月 参加期間:最大15週間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2015年3月26日に「ザファテックⓇ錠50mg/100mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病と診断されている方 同意取得時の年齢が20歳以上の方 HbA1c5.8%以上8.0%未満の方 食事療法、運動療法を実施している方 |
| 募集期限 | 2013年09月27日 |
【健康成人】 2泊3日×2回セット試験(関西)
| 問い合わせ番号 | 2991 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、既に発売されている薬剤の処方や製造方法の変更のために実施する試験となります。 試験実施時期:2012年8月 内容:2泊3日×2回+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年8月1日に「タリオンOD錠10mg」として販売承認されました。 |
| ご協力いただける方 | 同意取得時の年齢が20歳以上50歳以下の健康な日本人男性 BMIが18.5以上24.9未満の方 |
| 募集期限 | 2013年01月31日 |
【骨粗しょう症】骨粗しょう症患者対象の長期通院試験(関西)
| 問い合わせ番号 | 2989 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 原発性骨粗しょう症患者に12ヶ月間に9回通院いただき、有効性と安全を検証する目的で実施します。 試験開始時期:2012年8月 参加期間:12ヵ月間 内容:通院9回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年1月22日に「ボンビバ®錠100mg」として販売承認されました。 |
| ご協力いただける方 | 同意取得時に年齢が55歳以上の患者 腰椎の骨密度が若年成人平均値より低下している方 腰椎が脆弱性骨折の既往が有る方 歩行可能な外来患者 |
| 募集期限 | 2014年12月31日 |
【通年性アレルギー性鼻炎】12歳~64歳迄の鼻炎患者対象の長期投与試験(関西)
| 問い合わせ番号 | 2976 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回は、アレルギー性鼻炎の新しい治療、「舌下投薬による減感作療法」の治験となります。 室内の塵ダニ(ハウスダスト)が原因で年中、くしゃみ・鼻水・鼻詰まりの鼻炎症状がある12歳から64歳までの男性と女性に参加いただく内容です。5252週間で4週間から8週間毎に通院いただきます。多くのご応募をお待ちしております。 試験開始時期:2012年4月 参加期間:52週間 内容:通院12回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2015年9月28日に「ミティキュアダニ舌下錠3,300JAU/10,000JAU」として販売承認されました。 |
| ご協力いただける方 | 同意取得時の年齢が12歳以上65歳未満の男性と女性 季節問わず年中鼻炎症状がある方 本治験の実施の1年以上前から治療薬等で鼻炎症状の治療をしている方 ダニが原因でアレルギー性鼻炎の症状がある方 |
| 募集期限 | 2014年01月23日 |
【健康成人】健康成人男性対象の反復投与試験(関西)
| 問い合わせ番号 | 2946 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性を対象とした9泊10日×3回の入院試験のご案内です。 参加開始時期:2012年5月 内容:9泊10日×3回+通院1回 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・健康な日本人男性 ・同意取得時の年齢が20 歳以上35 歳以下の方 ・BMI が18.5 以上30.0 未満の方 |
| 募集期限 | 2012年10月12日 |
【糖尿病】食事療法、運動療法で治療中の方対象(関西)
| 問い合わせ番号 | 2928 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 会社の健康診断で血糖値が高いと指摘を受けた方や最近血糖値の数値が右肩上がりで高くなっている方必見! 糖尿病治療薬を使用されていない方対象に実施する試験となります。ご応募をお待ちしております。 試験開始時期:2012年4月 参加期間:6ヵ月間 内容:通院11回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2015年3月26日に「ザファテックⓇ錠50mg/100mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病と診断されている方 一定の食事療法、運動療法を実施している方 |
| 募集期限 | 2013年07月25日 |
【糖尿病】食事療法、運動療法で治療中の方対象(関東)
| 問い合わせ番号 | 2912 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 会社の健康診断で血糖値が高いと指摘を受けた方や最近血糖値の数値が右肩上がりで高くなっている方必見! 糖尿病治療薬を使用されていない方対象に実施する試験となります。ご応募をお待ちしております。 試験開始時期:2012年4月 参加期間:6ヵ月間 内容:通院11回 実施施設:東京都新宿区 この治験で使用された治験薬は、2015年3月26日に「ザファテックⓇ錠50mg/100mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病と診断されている方 一定の食事療法、運動療法を実施している方 |
| 募集期限 | 2012年04月25日 |
【脂質異常症】中性脂肪が高値の方対象の通院試験(関東)
| 問い合わせ番号 | 2888 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2012年5月 参加期間:6ヶ月 内容:通院8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・同意取得時の年齢が20歳以上の方 ・男性または閉経後女性 ・スクリーニング検査の血清TGが2回連続200㎎/dL以上の方 |
| 募集期限 | 2012年12月27日 |
【脂質異常症】中性脂肪が高値の方対象の通院試験(関西)
| 問い合わせ番号 | 2878 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2012年5月 参加期間:6ヶ月 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・同意取得時の年齢が20歳以上の方 ・男性または閉経後女性 ・スクリーニング検査の血清TGが2回連続200㎎/dL以上の方 |
| 募集期限 | 2012年12月13日 |
【髄膜炎菌ワクチン】100名に参加いただくワクチン試験(関西)
| 問い合わせ番号 | 2865 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のワクチンはトラベルワクチンです。海外渡航予定者が渡航先で感染症にかかるリスクを減らすために出国前に摂取すべき予防接種のワクチンです。髄膜炎性菌性髄膜炎の発症の報告年代として、15歳から19歳の発症が多いため、留学を予定している学生には特にお勧めのワクチン試験です。是非親子で一緒に参加してみてはいかがでしょうか。ご応募お待ちしております。 試験参加時期:2012年1月 内容:通院2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年7月4日に「メナクトラ筋注」として販売承認されました。 |
| ご協力いただける方 | 20歳未満の男性と女性 55歳までの男性と女性 |
| 募集期限 | 2012年04月01日 |
【髄膜炎菌ワクチン】100名に参加いただくワクチン試験(関東)
| 問い合わせ番号 | 2829 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のワクチンはトラベルワクチンです。海外渡航予定者が渡航先で感染症にかかるリスクを減らすために出国前に摂取すべき予防接種のワクチンです。髄膜炎性菌性髄膜炎の発症の報告年代として、15歳から19歳の発症が多いため、留学を予定している学生には特にお勧めのワクチン試験です。是非親子で一緒に参加してみてはいかがでしょうか。ご応募お待ちしております。 試験参加時期:2012年1月 内容:通院2回 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年7月4日に「メナクトラ筋注」として販売承認されました。 |
| ご協力いただける方 | 20歳未満の男性と女性 55歳までの男性と女性 |
| 募集期限 | 2012年05月01日 |
【健康成人】7泊8日の長期入院型治験(関西)
| 問い合わせ番号 | 2827 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験参加時期:2011年11月 内容:7泊8日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年7月4日に「エピデュオゲル」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の健康な成人男性 治験実施計画書の規定を遵守する意思のある方 |
| 募集期限 | 2011年11月30日 |
【糖尿病】腎機能障害を伴う2型糖尿病患者対象(関東)
| 問い合わせ番号 | 2801 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 腎機能障害を伴う2型糖尿病患者の方を対象に52週間の長期投与した際の安全性と有効性を検証する内容です。 試験開始時期:2011年5月 参加期間:52週間 内容:通院17回(2~4週間毎) 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・来院1においてHbA1c(JDS 値)が6.5%以上10.0%以下の方 ・来院1においてeGFR(mL/min/1.73m2)が30 以上59 以下の方 ・一定の食事療法を来院1の8 週間以上前から実施している方 ・20歳以上の男女 |
| 募集期限 | 2012年11月30日 |
【健康成人】4泊5日の短期入院型治験(関西)
| 問い合わせ番号 | 2794 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験参加時期:2011年7月 内容:4泊5日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年7月4日に「エピデュオゲル」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の健康な成人男性 治験実施計画書の規定を遵守する意思のある方 |
| 募集期限 | 2011年09月30日 |
【糖尿病】日頃から食事療法を行っている方対象の通院型治験(関東)
| 問い合わせ番号 | 2788 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 食事療法を継続して行っている2型糖尿病患者を対象とした通院型治験のご案内です。治験で指定する2種類の治験薬のどちらかを服用いただき、有効性と安全性を比較検証する内容です。 試験開始時期:2011年9月 参加期間:9ヶ月間 内容:来院10回(2~4週間毎) 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・来院1において、HbA1c(JDS値)が6.5%以上10.0%以下の方 ・来院1において、空腹時血糖値が126 mg/dL以上であることが確認された方 ・一定の食事療法を来院1の6週間以上前から実施している方 ・年齢20歳以上75歳未満(文書同意取得時)の方 |
| 募集期限 | 2012年11月30日 |
【糖尿病】1剤で治療中の方対象の長期投与試験(関東)
| 問い合わせ番号 | 2770 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 経口血糖降下薬単剤による治療では血糖コントロール不十分な2 型糖尿病患者を対象に、52 週間投与した時の長期安全性および有効性を検討する内容です。 試験開始時期:2011年4月 参加期間:52週間 内容:通院17回 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2 型糖尿病と診断されている方 経口血糖降下薬1剤で治療を受けている方 Visit1でHbA1cが7.0%以上10.0%以下 Visit1でのBMIが45.0㎏/㎡以下 |
| 募集期限 | 2013年04月16日 |
【健康成人】2泊3日の短期通院型試験(関西)
| 問い合わせ番号 | 2761 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、既に発売されているお薬の添加物を見直し、防湿性を改善し、これまでもお薬より2~3ヵ月間長く保存ができるようになります。 試験開始時期:2012年8月 内容:2泊3日×2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年10月3日に「オパルモン錠」として販売承認されました。 |
| ご協力いただける方 | 20歳から35歳までの健康な日本人男性 BMI:18.5から34.9 |
| 募集期限 | 2013年01月27日 |
【健康成人】白人も参加する5泊6日の宿泊試験(関西)
| 問い合わせ番号 | 2749 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 本試験は、健康な日本人と白人の2投与群を対象とし、安全性と忍容性を検証する内容です。 試験参加時期:2011年4月 内容:5泊6日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2015年9月28日に「ベンテイビス®吸入液10㎍」として販売承認されました。 |
| ご協力いただける方 | 日本人および白人の健康成人男子志願者 年齢:20~40歳 BMI:18 kg/m2以上、30 kg/m2未満の方 非喫煙者の方 |
| 募集期限 | 2011年06月20日 |
【糖尿病】未治療の2型糖尿病患者対象長期投与試験(関西)
| 問い合わせ番号 | 2744 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 2型糖尿病患者を対象に52週間投与した時の安全性と忍容性を検証する内容です。 試験開始時期:2011年2月 参加期間:52週間 内容:通院6回 実施施設:大阪府吹田市 >この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者で食事療法及び運動療法のみで治療している方 20歳以上70歳以下 BMIが45.0以下の方 Visit 1a でのHbA1c が次の基準を満たす患者: 経口糖尿病治療薬で治療を受けていない患者:HbA1c が7.0%以上かつ10.0%以下 |
| 募集期限 | 2013年05月13日 |
【糖尿病】未治療の2型糖尿病患者対象長期投与試験(関東)
| 問い合わせ番号 | 2705 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 2型糖尿病患者を対象に52週間投与した時の安全性と忍容性を検証する内容です。 試験開始時期:2011年2月 参加期間:52週間 内容:通院6回 実施施設:東京都新宿区 >この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者で食事療法及び運動療法のみで治療している方 20歳以上70歳以下 BMIが45.0以下の方 Visit 1a でのHbA1c が次の基準を満たす患者: 経口糖尿病治療薬で治療を受けていない患者:HbA1c が7.0%以上かつ10.0%以下 |
| 募集期限 | 2013年05月16日 |
【糖尿病】1剤で治療中の方対象の長期投与試験(関西)
| 問い合わせ番号 | 2663 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 経口血糖降下薬単剤による治療では血糖コントロール不十分な2 型糖尿病患者を対象に、52 週間投与した時の長期安全性および有効性を検討する内容です。 試験開始時期:2011年4月 参加期間:52週間 内容:通院17回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2 型糖尿病と診断されている方 経口血糖降下薬1剤で治療を受けている方 Visit1でHbA1cが7.0%以上10.0%以下 Visit1でのBMIが45.0㎏/㎡以下 |
| 募集期限 | 2013年04月13日 |
【脂質異常症】TG高値かつHDL低値を示す脂質異常症患者対象(関東)
| 問い合わせ番号 | 2601 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 中性脂肪の数値が高く、HDL-Cの数値が低い数値の脂質異常症患者を対象に有効性と安全性を検証する内容です。 試験開始時期:2010年11月 参加期間:最大24週間 内容:8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・同意取得時の年齢が20 歳以上75 歳未満の方 ・男性または閉経後女性 ・スクリーニング検査の血清TG が2 回連続200 mg/dL 以上の方 ・スクリーニング検査の血清HDL-C が2 回連続 50 mg/dL 未満の男性または55 mg/dL 未満の女性 |
| 募集期限 | 2011年07月20日 |
【脂質異常症】TG高値かつHDL低値を示す脂質異常症患者対象(関西)
| 問い合わせ番号 | 2584 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 中性脂肪の数値が高く、HDL-Cの数値が低い数値の脂質異常症患者を対象に有効性と安全性を検証する内容です。 試験開始時期:2010年11月 参加期間:最大24週間 内容:8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・同意取得時の年齢が20 歳以上75 歳未満の方 ・男性または閉経後女性 ・スクリーニング検査の血清TG が2 回連続200 mg/dL 以上の方 ・スクリーニング検査の血清HDL-C が2 回連続 50 mg/dL 未満の男性または55 mg/dL 未満の女性 |
| 募集期限 | 2011年07月20日 |
【健康成人】3泊4日+通院1回の入院型治験のご案内(関西)
| 問い合わせ番号 | 2571 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 募集人数:96名 ParT1・・・4試験(各12名 合計48名) ParT2・・・2試験(各12名 合計24名) ParT3・・・2試験(各12名 合計24名) 試験開始時期:2010年10月 内容 ParT1:3泊4日+通院1回 PatT2:3泊4日+通院1回 ParT3:9泊10日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2015年3月26日に「ワントラムⓇ錠 100mg」として販売承認されました。 |
| ご協力いただける方 | 20歳から39歳までの健康な男性 BMI:17.6~26.4 |
| 募集期限 | 2011年06月30日 |
【健康成人】2泊3日×4回セット(関西)
| 問い合わせ番号 | 2557 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2010年9月 内容:2泊3日×4セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年3月24日に「アテディオ配合錠」として販売承認されました。 |
| ご協力いただける方 | 20歳から45歳までの健康な日本人男性 BMI:18.5以上25.0未満 |
| 募集期限 | 2010年11月01日 |
【男性型脱毛症】男性型脱毛症患者対象の半年間通院試験(関東)
| 問い合わせ番号 | 2550 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 男性型脱毛症患者を対象に、治験薬を24週間投与し、安全性及び有効性を評価する内容です。 後頭部付近が薄毛でお悩みの方必見!!この機会に是非お申し込み下さい。 試験開始時期:2010年11月 参加期間:24週間 実施施設:東京都新宿区 この治験で使用された治験薬は、2015年9月28日に「ザガーロカプセル0.1mg/05.mg」として販売承認されました。 |
| ご協力いただける方 | 20歳~50歳の男性外来患者 Nowood-Hamilton分類のⅢvertex、ⅣまたはⅤのいづれかの男性型脱毛症のタイプに該当する方 治験期間中は毛髪の色や髪形を変えないなど治験の要件を遵守する意思がある方 |
| 募集期限 | 2012年04月12日 |
【健康成人】健康成人男性対象の反復投与試験(関西)
| 問い合わせ番号 | 2506 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性を対象に、3泊4日の入院を3回参加いただき、入院期間中に指定された薬剤(錠剤タイプ)を服用していただき、それぞれ異なるお薬の比較検証する内容です。 試験開始時期:2010年8月 内容:3泊4日×3 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年3月24日に「ルセフィ®錠2.5mg/ルセフィ®錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・日本人健康成人男性で同意取得時の年齢が20歳以上40歳未満の方 ・スクリーニング検査実施日のBMIが18.5 kg/m2以上25.0 kg/m2未満の方 |
| 募集期限 | 2010年12月31日 |
【健康成人】健康成人男性対象の複数入院試験(関西)
| 問い合わせ番号 | 2488 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 2種類の異なる薬剤をそれぞれ服用いただき、安全性を検証する内容です。 参加開始時期:2010年9月 内容:8泊9日×3回+通院1回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・健康成人男性 ・同意取得時の年齢が20 歳以上35 歳以下の方 ・BMI が18.5 以上30.0 未満の方 |
| 募集期限 | 2010年12月06日 |
【健康成人】健康成人男性対象の8泊9日入院試験(関西)
| 問い合わせ番号 | 2487 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 8泊9日の入院を3回し、その入院期間毎にそれぞれ異なる薬剤を服用いただき、安全性を検証する内容です。 試験参加時期:2010年9月 内容:8泊9日×3回+通院1回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・健康成人男性 ・同意取得時の年齢が20 歳以上35 歳以下の方 ・BMI が18.5 以上30.0 未満の方 |
| 募集期限 | 2010年11月30日 |
【糖尿病】2型糖尿病患者対象の通院型試験(関東)
| 問い合わせ番号 | 2472 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 未治療の糖尿病患者を対象に、12週間に7回通院いただく、通院型治験のご案内です。有効性と安全性を2種類の薬剤を使用して比較検証する内容です。 試験開始時期:2010年6月 参加期間:4ヵ月間 内容:通院7回 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・年齢20歳以上75歳未満(文書同意取得時)の方 ・一定の食事療法を来院1の8週間以上前から実施している方 ・来院1のHbA1cが6.5%以上10.0%以下の方 |
| 募集期限 | 2011年04月30日 |
【不眠症】短期通院型試験モニター(関西)
| 問い合わせ番号 | 2450 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬はこれまでに発売されているお薬とは異なる作用を持つ、全く新しいお薬となります。これまでの薬剤と比べ依存性も少なく、自然な睡眠を促す薬剤です。不眠でお悩みの方はぜひご応募ください。お待ちしております。 治験実施時期:2010年3月 参加期間:4ヵ月間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年9月26日に「ベルソムラ®錠15 mg/20 mg」として販売承認されました。 |
| ご協力いただける方 | 同意取得時の年齢が20歳以上の方 治験参加前に平均睡眠時間が6.5時間未満の方 夜間何度も目が覚める方 |
| 募集期限 | 2012年04月30日 |
【糖尿病】指定する1種類の薬剤で治療中の方対象長期投与試験(関東)
| 問い合わせ番号 | 226 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 食事療法、運動療法に加え、SU剤を使用していても血糖コントロールが不十分な2型糖尿病患者にご協力いただく治験のご案内です。 参加開始時期:2008年8月 参加期間:13ヵ月間 内容:通院18回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年4月16日に「ネシーナ錠25mg/ネシーナ錠12.5mg/ネシーナ錠6.25mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の男女 ・2型糖尿病と診断されている方 ・治験開始の4週間以上前からSU剤を使用している方 ・HbA1c7.0以上10.0未満 ・食事療法もしくは運動療法を実施している方 |
| 募集期限 | 2010年02月28日 |
【糖尿病】1剤もしくは2剤で治療中の2型糖尿病の方対象(関東)
| 問い合わせ番号 | 222 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 本治験で指定する経口糖尿病治療薬のみで治療中の方、もしくは他の経口糖尿病治療薬と合わせ2剤で治療中の方を対象に、6ヵ月間実施し、有効性と安全性を検証する比較試験のご案内です。 試験開始時期:2008年11月 参加期間:6ヵ月間 内容:通院7回 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上80歳以下 ・BMI40未満の方 ・2型糖尿病の診断を受けた方で、本治験で指定する経口糖尿病治療薬のみ、または本治験で指定する経口糖尿病治療薬と他の経口糖尿病治療薬と合わせて2剤で治療を受けている方 ・スクリーニングでのHbA1cの基準値が以下に該当する方 ◎1剤で治療中の方 HbA1c7.5以上10.0以下 ◎2剤で治療中の方 HbA1c7.0以上9.0以下 |
| 募集期限 | 2009年11月29日 |
【糖尿病】指定する1種類の薬剤で治療中の方対象(関東)
| 問い合わせ番号 | 221 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 食事療法、運動療法に加え、SU剤を使用していても血糖コントロールが不十分な2型糖尿病患者にご協力いただく治験のご案内です。 試験開始時期:2008年8月 参加期間:6ヵ月間 内容:通院8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年4月16日に「ネシーナ錠25mg/ネシーナ錠12.5mg/ネシーナ錠6.25mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の男女 ・2型糖尿病と診断されている方 ・治験開始の4週間以上前からSU剤を使用している方 ・HbA1c7.0以上10.0未満 ・食事療法もしくは運動療法を実施している方 |
| 募集期限 | 2010年02月28日 |
【糖尿病】1剤もしくは2剤で治療中の方対象の長期投与試験(関東)
| 問い合わせ番号 | 220 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 1剤もしくは2剤までで治療中の2型糖尿病の方を対象に本治験の治験薬を78週間投与した時の安全性と忍容性を検討する長期投与試験のご案内です。 試験開始時期:2008年7月 参加期間:19ヶ月間 内容:通院9回 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上80歳以下 ・BMI40未満の方 ・2型糖尿病の診断を受けた方で、本治験で指定する経口糖尿病治療薬のみ、または本治験で指定する経口糖尿病治療薬と他の経口糖尿病治療薬と合わせて2剤で治療を受けている方 ・スクリーニングでのHbA1cの基準値が以下に該当する方 ◎1剤で治療中の方 HbA1c7.5以上10.0以下 ◎2剤で治療中の方 HbA1c7.0以上9.0以下 |
| 募集期限 | 2010年12月30日 |
【糖尿病】血糖コントロール不良の2型糖尿病患者対象比較試験(関東)
| 問い合わせ番号 | 218 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 血糖コントロール不良の2型糖尿病の方に、本治験用の治験薬と、併用療法として本治験の指定する経口糖尿病治療薬をご使用いただきながら、有効性を比較する内容です。 試験開始時期:2008年2月 参加期間:6ヵ月間 内容:通院8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病と診断されている方 ・20歳以上80歳以下の男女 ・BMIが40未満の方 ・スクリーニング時のHbA1c値が以下の条件に合致する方 ◎経口糖尿病治療薬を使用している方 HbA1c7.0以上9.5以下 ◎経口糖尿病治療薬を使用していない方 HbA1c7.5以上11.0以下 |
| 募集期限 | 2009年06月29日 |
【糖尿病】2型糖尿病患者を対象とした長期投与試験(関東)
| 問い合わせ番号 | 217 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 血糖コントロール不良の2型糖尿病患者を対象とした、54週間参加頂く長期投与試験のご案内です。 参加参加時期:2007年12月 参加期間:14ヵ月間 内容:プラセボ導入期:2週間 治療期:52週間 通院20回 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・日本人の2型糖尿病患者で、指定する経口血糖降下剤(1剤もしくは2剤)で治療されている方 もしくは 治験に参加頂く10週間前から経口血糖降下剤による治療を受けたことが無い方 ・スクリーニング時のHbA1cが以下の条件に合致する方 ◎経口血糖降下剤で治療をされていない方 HbA1c7.0以上10.0以下 ◎経口血糖降下剤(1剤または2剤)で治療されている方 HbA1c7.0以上9.0以下 ・年齢20歳以上80歳以下 ・BMI40.0未満の方 |
| 募集期限 | 2010年01月30日 |
【脂質異常症】高TG血症患者対象入院試験(関西)
| 問い合わせ番号 | 184 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 高TG血症患者対象に指定する薬剤を服用した際の安全性を検討する内容です。 参加開始時期:2009年4月 内容:3泊4日×2+通院1回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・同意取得時の年齢が20 歳以上65 歳未満の男性 ・BMI が18.5 以上35.0 未満の方 ・2回のスクリーニング検査でトリグリセリド(TG)値がいずれも150 mg/dL 以上400 mg/dL 未満の高TG 血症患者 |
| 募集期限 | 2009年08月31日 |
【健康成人】健康成人対象入院試験(関西)
| 問い合わせ番号 | 179 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康男性対象に指定する薬剤を服用した際の安全性を検討する内容です。 参加開始時期:2009年4月 内容:9泊10日+通院1回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・健康成人男性 ・同意取得時の年齢が20 歳以上35 歳以下の方 ・BMI が18.5 以上30.0 未満の方 |
| 募集期限 | 2009年08月31日 |
【糖尿病】指定する1種類の薬剤で治療中の方対象長期投与試験(関西)
| 問い合わせ番号 | 167 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 食事療法、運動療法に加え、SU剤を使用していても血糖コントロールが不十分な2型糖尿病患者にご協力いただく治験のご案内です。 参加開始時期:2008年8月 参加期間:13ヵ月間 内容:通院18回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年4月16日に「ネシーナ錠25mg/ネシーナ錠12.5mg/ネシーナ錠6.25mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の男女 ・2型糖尿病と診断されている方 ・治験開始の4週間以上前からSU剤を使用している方 ・HbA1c7.0以上10.0未満 ・食事療法もしくは運動療法を実施している方 |
| 募集期限 | 2010年02月28日 |
【健康成人】健康成人対象6泊7日の入院試験(関西)
| 問い合わせ番号 | 153 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な成人男性に参加いただき、食事の影響を検証する内容です。 試験開始時期:2009年2月 内容7泊8日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2017年7月3日に「パルモディア錠0.1mg」として販売承認されました |
| ご協力いただける方 | ・健康成人男性 ・同意取得時の年齢が20 歳以上35歳以下の方 ・BMIが18.5以上30.0 kg/m2未満の方 |
| 募集期限 | 2009年02月20日 |
【糖尿病】1剤もしくは2剤で治療中の方対象の長期投与試験(関西)
| 問い合わせ番号 | 149 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 1剤もしくは2剤までで治療中の2型糖尿病の方を対象に本治験の治験薬を78週間投与した時の安全性と忍容性を検討する長期投与試験のご案内です。 参加開始時期:2008年7月 参加期間:19ヶ月間 内容:通院9回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上80歳以下 ・BMI40未満の方 ・2型糖尿病の診断を受けた方で、本治験で指定する経口糖尿病治療薬のみ、または本治験で指定する経口糖尿病治療薬と他の経口糖尿病治療薬と合わせて2剤で治療を受けている方 ・スクリーニングでのHbA1cの基準値が以下に該当する方 ◎1剤で治療中の方 HbA1c7.5以上10.0以下 ◎2剤で治療中の方 HbA1c7.0以上9.0以下 |
| 募集期限 | 2010年12月30日 |
【糖尿病】1剤もしくは2剤で治療中の2型糖尿病の方対象(関西)
| 問い合わせ番号 | 147 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 本治験で指定する経口糖尿病治療薬のみで治療中の方、もしくは他の経口糖尿病治療薬と合わせ2剤で治療中の方を対象に、6ヵ月間実施し、有効性と安全性を検証する比較試験のご案内です。 参加開始時期:2008年11月 参加期間:6ヵ月間 内容:通院7回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上80歳以下 ・BMI40未満の方 ・2型糖尿病の診断を受けた方で、本治験で指定する経口糖尿病治療薬のみ、または本治験で指定する経口糖尿病治療薬と他の経口糖尿病治療薬と合わせて2剤で治療を受けている方 ・スクリーニングでのHbA1cの基準値が以下に該当する方 ◎1剤で治療中の方 HbA1c7.5以上10.0以下 ◎2剤で治療中の方 HbA1c7.0以上9.0以下 |
| 募集期限 | 2009年11月29日 |
【糖尿病】1剤もしくは2剤で治療中の2型糖尿病の方対象(関西)
| 問い合わせ番号 | 144 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 本治験で指定する経口糖尿病治療薬のみで治療中の方、もしくは他の経口糖尿病治療薬と合わせ2剤で治療中の方を対象に、6ヵ月間実施し、有効性と安全性を検証する比較試験のご案内です。 参加開始時期:2008年11月 参加期間:6ヵ月間 内容:通院7回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上80歳以下 ・BMI40未満の方 ・2型糖尿病の診断を受けた方で、本治験で指定する経口糖尿病治療薬のみ、または本治験で指定する経口糖尿病治療薬と他の経口糖尿病治療薬と合わせて2剤で治療を受けている方 ・スクリーニングでのHbA1cの基準値が以下に該当する方 ◎1剤で治療中の方 HbA1c7.5以上10.0以下 ◎2剤で治療中の方 HbA1c7.0以上9.0以下 |
| 募集期限 | 2009年11月29日 |
【健康成人】健康成人男性対象の同等性試験(関西)
| 問い合わせ番号 | 84 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性を対象に、5泊6日の入院を2回参加いただき、入院期間中に指定された薬剤(錠剤タイプ)を服用していただき、それぞれ異なるお薬の比較検証する内容です。 治験開始時期:2008年11月 内容:5泊6日×2 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年4月22日に「グルベス配合錠」として販売承認されました。 |
| ご協力いただける方 | ・年齢20 歳以上35 歳以下(同意取得時)の健康な日本人男性 ・BMI:18.5 kg/m2以上25.0 kg/m2未満 |
| 募集期限 | 2009年03月03日 |
【健康成人】5泊6日×2回(関西)
| 問い合わせ番号 | 79 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、これまでに発売されている他の糖尿病治療薬と異なり、糖尿病の進展を抑制し、他の合併症の予防につながると考えられている、新しい糖尿病治療薬として期待されております。 試験開始時期:2008年10月 内容:5泊6日×2回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年7月4日に「カナグル錠100mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上50歳以下の健康成人男性 BMIが18.5以上24.9以下の方 |
| 募集期限 | 2008年11月30日 |
【糖尿病】糖尿病患者対象の入院型試験(関西)
| 問い合わせ番号 | 75 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、これまでに発売されている他の糖尿病治療薬と異なり、糖尿病の進展を抑制し、他の合併症の予防につながると考えられている、新しい糖尿病治療薬として期待されております。 糖尿病で治療されている方や、血糖値が高いと指摘を受けた方はぜひご応募ください。 試験開始時期:2008年10月 内容:9泊10日+5泊6日+通院2回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年7月4日に「カナグル錠100mg」として販売承認されました。 |
| ご協力いただける方 | 1剤もしくは2剤までの経口糖尿病治療薬で治療している方 同意取得時の年齢が25歳以上65歳以下 BMIが18.5以上39.9以下 糖尿病の診断指標であるHbA1cが6.5%以上10%以下 |
| 募集期限 | 2008年06月01日 |
【糖尿病】1剤もしくは2剤で治療中の方対象の長期投与試験(関西)
| 問い合わせ番号 | 74 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 1剤もしくは2剤までで治療中の2型糖尿病の方を対象に本治験の治験薬を78週間投与した時の安全性と忍容性を検討する長期投与試験のご案内です。 参加開始時期:2008年7月 参加期間:19ヶ月間 内容:通院9回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上80歳以下 ・BMI40未満の方 ・2型糖尿病の診断を受けた方で、本治験で指定する経口糖尿病治療薬のみ、または本治験で指定する経口糖尿病治療薬と他の経口糖尿病治療薬と合わせて2剤で治療を受けている方 ・スクリーニングでのHbA1cの基準値が以下に該当する方 ◎1剤で治療中の方 HbA1c7.5以上10.0以下 ◎2剤で治療中の方 HbA1c7.0以上9.0以下 |
| 募集期限 | 2010年12月30日 |
【健康成人】健康成人男性対象の短期入院試験(関西)
| 問い合わせ番号 | 51 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康成人男性を対象に入院期間に1回だけ指定する薬剤を服用し、安全性を検証する内容です。 試験開始時期:2008年7月 内容:3泊4日+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2017年3月3日に「パルモディア錠0.1mg」として販売承認されました。 |
| ご協力いただける方 | ・健康成人男性 ・同意取得時の年齢が20 歳以上35 歳以下の方 ・BMI が18.5 以上30.0 未満の方 |
| 募集期限 | 2008年07月01日 |
【糖尿病】未治療の2型糖尿病の方対象の通院試験(関西)
| 問い合わせ番号 | 40 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 未治療の2型糖尿病患者を対象の通院型治験のご案内です。2週間ごとに通院していただき、治験期間中はご自身で注射を行っていただく内容となります。 参加開始時期:2008年5月 参加期間:3ヵ月間 内容:通院10回 治験施設:大阪府吹田市 この治験で使用された治験薬は、2013年6月28日に「リキスミアⓇ」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病と診断された方 ・スクリーニング時点の年齢が20歳以上 ・スクリーニング時点でHbA1c7.0%以上10.0%未満 ・スクリーニング前3ヵ月以内に糖尿病治療薬の投与を受けたことがない方 ・スクリーニング前3ヵ月以内に他の治験薬を使用した方 |
| 募集期限 | 2009年12月14日 |
【糖尿病】血糖コントロール不良の2型糖尿病患者対象比較試験(関西)
| 問い合わせ番号 | 35 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 血糖コントロール不良の2型糖尿病の方に、本治験用の治験薬と、併用療法として本治験の指定する経口糖尿病治療薬をご使用いただきながら、有効性を比較する内容です。 参加開始時期:2008年2月 参加期間:6ヵ月間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病と診断されている方 ・20歳以上80歳以下の男女 ・BMIが40未満の方 ・スクリーニング時のHbA1c値が以下の条件に合致する方 ◎経口糖尿病治療薬を使用している方 HbA1c7.0以上9.5以下 ◎経口糖尿病治療薬を使用していない方 HbA1c7.5以上11.0以下 |
| 募集期限 | 2009年06月29日 |
【糖尿病】2型糖尿病患者を対象とした長期投与試験(関西)
| 問い合わせ番号 | 34 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 血糖コントロール不良の2型糖尿病患者を対象とした、54週間参加頂く長期投与試験のご案内です。 参加開始時期:2007年12月 参加期間:14ヵ月間 内容:プラセボ導入期:2週間 治療期:52週間 通院20回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・日本人の2型糖尿病患者で、指定する経口血糖降下剤(1剤もしくは2剤)で治療されている方 もしくは 治験に参加頂く10週間前から経口血糖降下剤による治療を受けたことが無い方 ・スクリーニング時のHbA1cが以下の条件に合致する方 ◎経口血糖降下剤で治療をされていない方 HbA1c7.0以上10.0以下 ◎経口血糖降下剤(1剤または2剤)で治療されている方 HbA1c7.0以上9.0以下 ・年齢20歳以上80歳以下 ・BMI40.0未満の方 |
| 募集期限 | 2010年01月30日 |
【糖尿病】2型糖尿病患者を対象とした長期投与試験(関西)
| 問い合わせ番号 | 33 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 血糖コントロール不良の2型糖尿病患者を対象とした、54週間参加頂く長期投与試験のご案内です。 参加開始時期:2007年12月 参加期間:14ヵ月間 内容:プラセボ導入期:2週間 治療期:52週間 通院20回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・日本人の2型糖尿病患者で、指定する経口血糖降下剤(1剤もしくは2剤)で治療されている方 もしくは 治験に参加頂く10週間前から経口血糖降下剤による治療を受けたことが無い方 ・スクリーニング時のHbA1cが以下の条件に合致する方 ◎経口血糖降下剤で治療をされていない方 HbA1c7.0以上10.0以下 ◎経口血糖降下剤(1剤または2剤)で治療されている方 HbA1c7.0以上9.0以下 ・年齢20歳以上80歳以下 ・BMI40.0未満の方 |
| 募集期限 | 2010年01月30日 |
【糖尿病】1剤で治療中の方対象の12週間、6回通院(関東)
| 問い合わせ番号 | -4326 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 2型糖尿病患者を対象に、治験薬と指定する糖尿病治療薬の併用療法による有効性と安全性を検証する試験のご案内です。 参加開始時期:2008年8月 参加期間:4ヵ月間 内容:通院6回 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年1月21日に「ソニアス配合錠LD/HD」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の男女 ・HbA1c7.0以上10.0未満 ・治験参加の4週間前から食事療法、運動療法を実施している方 ・治験参加の4週間前から糖尿病1剤で治療している方 |
| 募集期限 | 2009年03月31日 |
【糖尿病】未治療の方対象の長期投与試験(関東)
| 問い合わせ番号 | -4343 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 糖尿病の治療薬を使用せず、運動療法や食事療法のみで治療されている方を対象に、長期間にわたり、お薬の安全性と効果を検証する試験のご案内です。 参加開始期間:2007年3月 参加期間:13ヵ月間 内容:通院12回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年4月16日に「ネシーナ錠25mg/ネシーナ錠12.5mg/ネシーナ錠6.25mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の方 ・HbA1c6.5以上10.0未満 ・糖尿病の治療薬を使用していない方 ・食事療法及び運動療法を継続して実施している方 |
| 募集期限 | 2009年02月01日 |
【糖尿病】2型糖尿病患者を対象とした入院試験(関東)
| 問い合わせ番号 | -4346 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 日本人2型糖尿病患者を対象に2泊3日の入院を2回していただきながら、1ヵ月間指定する治験薬を服用していただき、安全性を検証する試験です。 参加開始時期:2007年1月 参加期間:2ヵ月間 内容:治療期間:4週間、後観察期間:2週間 入院2回+通院:8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病の方で、運動療法又は食事療法で治療されている方、もしくは指定する経口血糖降下剤(1種類)で治療されている方 ・HbA1c8.5%以下の方 ・21歳以上70歳以下の日本人の方 ・BMI:17.6以上35.0以下の方 |
| 募集期限 | 2007年06月30日 |
【健康成人】18泊19日の長期試験(関西)
| 問い合わせ番号 | -4467 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験参加時期:2008年1月 内容:18泊19日+通院1回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2015年9月30日に「スピオルト®レスピマット®28吸入」として販売承認されました。 |
| ご協力いただける方 | 20歳以上35歳以下の日本人成人男性 BMIが18.5 kg/m2以上かつ25.0 kg/m2以下 |
| 募集期限 | 2008年05月31日 |
【糖尿病】未治療の方対象の長期投与試験(関西)
| 問い合わせ番号 | -4518 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 糖尿病の治療薬を使用せず、運動療法や食事療法のみで治療されている方を対象に、長期間にわたり、お薬の安全性と効果を検証する試験のご案内です。 参加開始期間:2007年3月 参加期間:13ヵ月間 内容:通院12回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年4月16日に「ネシーナ錠25mg/ネシーナ錠12.5mg/ネシーナ錠6.25mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の方 ・HbA1c6.5以上10.0未満 ・糖尿病の治療薬を使用していない方 ・食事療法及び運動療法を継続して実施している方 |
| 募集期限 | 2009年02月01日 |
【健康成人】健康な高齢者も参加可能3泊4日(関西)
| 問い合わせ番号 | -4534 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験参加時期:2007年9月 内容:3泊4日 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年9月28日に「ウプトラビ錠0.2mg・ウプトラビ錠0.4mg」として販売承認されました。 |
| ご協力いただける方 | ・健康成人男子20歳以上、45歳未満 ・健康高齢男子65歳以上、80歳未満 ・BMIが17.6~26.4の者 |
| 募集期限 | 2008年03月31日 |
【健康成人】健康成人男性対象の同等性試験(関西)
| 問い合わせ番号 | -4571 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 日本人の健康成人の男性を対象に、4泊5日の入院期間ごとに指定する薬剤(錠剤タイプ)を服用していただき、比較検証する内容です。 治験開始時期:2007年3月 内容:4泊5日×2回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年4月16日に「メタクト配合錠 LD/HD」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上35歳以下の日本人の健康成人男性 ・スクリーニング検査時の体重が50.0 kg以上の方 ・スクリーニング検査時のBMIが18.0以上24.9以下の方 |
| 募集期限 | 2007年03月01日 |
【健康成人】10泊11日の長期入院型試験(関西)
| 問い合わせ番号 | -4578 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、緑内障患者向けの点眼薬です。既に発売されている点眼薬とは異なる全く新しい効果のある点眼薬です。 緑内障治療薬の第一選択薬であるラタノプロスト(PG製剤)よりも眼圧下降が期待されています。 試験実施期間:2006年7月 内容:10泊11日+1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年9月26日に「グラナテック®点眼液0.4%」として販売承認されました。 |
| ご協力いただける方 | 20歳から35歳までの健康な日本人男性 BMI17.6㎏/㎡以上26.4㎏/㎡ SCR時の眼圧が13.0mmHg以上の方 |
| 募集期限 | 2007年09月27日 |
【糖尿病】2型糖尿病患者を対象とした入院試験(関西)
| 問い合わせ番号 | -4583 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 日本人2型糖尿病患者を対象に2泊3日の入院を2回していただきながら、1ヵ月間指定する治験薬を服用していただき、安全性を検証する試験です。 参加開始時期:2007年1月 参加期間:2ヵ月間 内容:治療期間:4週間、後観察期間:2週間 入院2回+通院:8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年7月1日に「トラゼンタ®錠5mg 」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病の方で、運動療法又は食事療法で治療されている方、もしくは指定する経口血糖降下剤(1種類)で治療されている方 ・HbA1c8.5%以下の方 ・21歳以上70歳以下の日本人の方 ・BMI:17.6以上35.0以下の方 |
| 募集期限 | 2007年06月30日 |
【健康成人】健康成人男性対象の同等性試験(関西)
| 問い合わせ番号 | -4620 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 日本人の健康成人の男性を対象に、4泊5日の入院期間ごとに指定する薬剤(錠剤タイプ)を服用していただき、比較検証する内容です。 治験開始時期:2006年7月 内容:4泊5日×3回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年4月16日に「メタクト配合錠 LD/HD」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上35歳以下の日本人の健康成人男性 ・スクリーニング検査時の体重が50.0 kg以上の方 ・スクリーニング検査時のBMIが18.0以上24.9以下の方 |
| 募集期限 | 2006年12月01日 |
【糖尿病】未治療で、食事療法または運動療法を実施している方(関西)
| 問い合わせ番号 | -4622 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 糖尿病治療薬を12週間服用していただき、効果と安全性を検証する試験のご案内です。 参加開始時期:2006年7月 参加期間:3ヵ月間 内容:通院6回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年1月20日に「エクア錠50mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 糖尿病の治療薬を使用していない方 食事療法や運動療法を継続的に実施していただける方 指定する日時に来院可能な方 |
| 募集期限 | 2006年07月13日 |
【健康成人】4泊5日+1回 (関西)
| 問い合わせ番号 | -4634 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、緑内障患者向けの点眼薬です。既に発売されている点眼薬とは異なる全く新しい効果のある点眼薬です。 緑内障治療薬の第一選択薬であるラタノプロスト(PG製剤)よりも眼圧下降が期待されています。 試験実施期間:2006年7月 内容:4泊5日+1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年9月26日に「グラナテック®点眼液0.4%」として販売承認されました。 |
| ご協力いただける方 | 20歳から35歳までの健康な日本人男性 BMI:17.6以上26.4 |
| 募集期限 | 2006年11月30日 |
【糖尿病】通院型の長期投与試験(関東)
| 問い合わせ番号 | 3049 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 試験開始時期:2012年8月 参加期間:最大62週間 内容:通院15回 実施施設:東京都新宿区 この治験で使用された治験薬は、2015年9月28日に「マリゼブⓇ錠12.5mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者の方で以下の治療歴かつ検査数値 ①経口糖尿病治療薬単剤を服用している方:HbA1c6.5%以上9.0%以下 ②食事療法や運動療法のみで治療している方:HbA1c7.0%以上10.0%以下 BMI:18㎏/㎡以上40㎏/㎡未満 |
| 募集期限 | 2014年09月26日 |
【糖尿病】2型糖尿病患者対象の入院試験(関西)
| 問い合わせ番号 | 2483 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 2型糖尿病の方を対象に、2泊3日の入院を2回していただきながら、血糖コントロールに対する影響及び安全性についてプラセボと比較検証する内容です。 参加開始時期:2010年2月 参加期間:3ヵ月間 内容:2泊3日×2回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2012年6月29日に「テネリア®錠20mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上75歳以下の男女 ・試験開始8週間以上前から食事療法及び運動療法を実施している方 ・試験開始日のHbA1c6.5以上10.0未満 |
| 募集期限 | 2010年12月30日 |
【ワクチン】新型インフルエンザワクチン試験モニター 定員200名(関西)
| 問い合わせ番号 | 3006 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、新型インフルエンザワクチンのモニター試験です。 新型インフルエンザが大流行し、パンデミックが発生した際、迅速に感染拡大防止目的に、迅速かつ大量に供給が可能なインフルエンザワクチンが求められております。その目的で行うワクチンの通院型モニター試験です。200名の定員で実施。ご応募をお待ちしております。 試験開始時期:2012年9月 内容:通院3回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年3月24日に「沈降細胞培養インフルエンザワクチンH5N1筋注30㎍/mL,60㎍/mL 「北里第一三共」」として販売承認されました。 |
| ご協力いただける方 | 20歳から64歳までの健康な日本人男女 関西圏にお住まいの方 健康診断の結果より参加可能で、かつ定められた通院日程に来院できる方 |
| 募集期限 | 2012年12月02日 |
【スギ花粉症】国内初 舌下投与試験(関東)
| 問い合わせ番号 | 2493 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は、国内で初めて開発された、舌下に投与する減感作療法薬となります。注射による減感作療法と比べて、注射による痛みもなく、自宅で患者自身が治療できるため、QOLを高め、花粉シーズン中も少しでも快適に過ごせる可能性があるお薬です。 花粉症でお悩みの方は、是非ご応募下さい。 試験開始時期:2010年8月 参加期間:最大83週間 内容:最大通院24回 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年1月17日に「シダトレンⓇスギ花粉舌下液200JAU/mLボトル、2,000JAU/mLボトル」として販売承認されました。 |
| ご協力いただける方 | 20歳以上65歳以下の患者 実施前の2年間のスギ花粉飛散時期に鼻炎症状がある方 |
| 募集期限 | 2012年08月06日 |
【ワクチン】インフルエンザワクチン 100名募集(関東)
| 問い合わせ番号 | 2980 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 新型インフルエンザワクチンのパンデミックに備えて、新しいインフルエンザワクチンの開発、増産が求められております。その目的で今回開発されるインフルエンザワクチンのご案内です。 100名に参加頂く試験となります。多くのご応募をお待ちしております。 試験開始時期:2012年8月 内容:通院5回 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年3月24日に「乳濁細胞培養インフルエンザHAワクチンH5N1筋注用「化血研」」として販売承認されました。 |
| ご協力いただける方 | 20歳以上64歳以下の健康な男女 |
| 募集期限 | 2013年05月02日 |
【健康成人】4泊5日+通院3回(関西)
| 問い合わせ番号 | 2857 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、高齢者や嚥下困難な患者が、普通の薬剤と比べ口の中で飲み込みやすいように、服用しやすい剤形に変更された薬剤の試験です。 試験参加時期:2011年12月 内容:4泊5日+通院3回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年12月16日に「メマリーOD錠5mg/10mg/20mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上45歳以下の健康な日本人男性 BMI18.5以上25.0未満 |
| 募集期限 | 2012年03月02日 |
【健康成人】4泊5日+通院3回(関西)
| 問い合わせ番号 | 2859 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、高齢者や嚥下困難な患者が、普通の薬剤と比べ口の中で飲み込みやすいように、服用しやすい剤形に変更された薬剤の試験です。 試験参加時期:2011年12月 内容:4泊5日+通院3回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2013年12月16日に「メマリーOD錠5mg/10mg/20mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上45歳以下の健康な日本人男性 BMI18.5以上25.0未満 |
| 募集期限 | 2012年03月02日 |
【ワクチン】新型インフルエンザワクチン試験モニター 定員300名(関東)
| 問い合わせ番号 | 2999 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 今回のお薬は、新型インフルエンザワクチンのモニター試験です。 新型インフルエンザが大流行し、パンデミックが発生した際、迅速に感染拡大防止目的に、迅速かつ大量に供給が可能なインフルエンザワクチンが求められております。その目的で行うワクチンの通院型モニター試験です。200名の定員で実施。ご応募をお待ちしております。 試験開始時期:2012年9月 内容:通院3回 実施施設:東京都新宿区、東京都小金井橋市内 この治験で使用された治験薬は、2014年3月24日に「沈降細胞培養インフルエンザワクチンH5N1筋注30㎍/mL,60㎍/mL 「北里第一三共」」として販売承認されました。 |
| ご協力いただける方 | 20歳から64歳までの健康な日本人男女 関西圏にお住まいの方 健康診断の結果より参加可能で、かつ定められた通院日程に来院できる方 |
| 募集期限 | 2012年12月02日 |
【健康成人】健康成人男性対象の単回投与試験(関西)
| 問い合わせ番号 | 2892 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性を対象に、3泊4日の入院を3回参加いただき、入院期間中に指定された薬剤(錠剤タイプ)を服用していただき、それぞれ異なるお薬の比較検証する内容です。 試験開始時期:2012年1月 内容:3泊4日×3 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上40歳未満の日本人健康成人男性 ・スクリーニング検査実施日のBMIが18.5 kg/m2以上25.0kg/m2未満の方 |
| 募集期限 | 2012年03月31日 |
【糖尿病】日頃から食事療法を行っている方対象の通院型治験(関西)
| 問い合わせ番号 | 2756 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 食事療法を継続して行っている2型糖尿病患者を対象とした通院型治験のご案内です。治験で指定する2種類の治験薬のどちらかを服用いただき、有効性と安全性を比較検証する内容です。 試験開始時期:2011年9月 参加期間:9ヶ月間 内容:来院10回(2~4週間毎) 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・来院1において、HbA1c(JDS値)が6.5%以上10.0%以下の方 ・来院1において、空腹時血糖値が126 mg/dL以上であることが確認された方 ・一定の食事療法を来院1の6週間以上前から実施している方 ・年齢20歳以上75歳未満(文書同意取得時)の方 |
| 募集期限 | 2012年11月30日 |
【糖尿病】腎機能障害を伴う2型糖尿病患者対象(関西)
| 問い合わせ番号 | 2795 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 腎機能障害を伴う2型糖尿病患者の方を対象に52週間の長期投与した際の安全性と有効性を検証する内容です。 試験開始時期:2011年5月 参加期間:52週間 内容:通院17回(2~4週間毎) 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・来院1においてHbA1c(JDS 値)が6.5%以上10.0%以下の方 ・来院1においてeGFR(mL/min/1.73m2)が30 以上59 以下の方 ・一定の食事療法を来院1の8 週間以上前から実施している方 ・20歳以上の男女 |
| 募集期限 | 2012年11月30日 |
【糖尿病】1剤で治療中の方対象の長期投与試験(関西)
| 問い合わせ番号 | 2754 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 本治験で指定している経口血糖降下剤を使用されている2型糖尿病患者を対象に観察期4週と治療期52週と長期間ご参加いただく内容です。 試験開始時期:2011年4月 参加期間:14ヵ月間 内容:通院17回(2~4週間毎) 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・同意文書に署名いただく時点の年齢が20歳以上の方 ・来院1の8週間以上前から一定用量のSU薬(グリメピリド)を使用されている方 ・一定の食事療法を来院1の8週間以上前から行っている方 ・来院において、HbA1cが6.5 %以上10.0 %以下の方 |
| 募集期限 | 2012年11月30日 |
【糖尿病】2型糖尿病患者対象の通院型試験(関西)
| 問い合わせ番号 | 178 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 未治療の糖尿病患者を対象に、12週間に7回通院いただく、通院型治験のご案内です。有効性と安全性を2種類の薬剤を使用して比較検証する内容です。 試験開始時期:2009年3月 参加期間:4ヵ月間 内容:通院7回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・年齢20歳以上75歳未満(文書同意取得時)の方 ・一定の食事療法を来院1の8週間以上前から実施している方 ・来院1のHbA1cが6.5%以上10.0%以下の方 |
| 募集期限 | 2010年01月31日 |
【糖尿病】2型糖尿病患者対象の通院型試験(関西)
| 問い合わせ番号 | 2448 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 未治療の糖尿病患者を対象に、12週間に7回通院いただく、通院型治験のご案内です。有効性と安全性を2種類の薬剤を使用して比較検証する内容です。 試験開始時期:2010年6月 参加期間:4ヵ月間 内容:通院7回 参加施設:大阪府吹田市 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・年齢20歳以上75歳未満(文書同意取得時)の方 ・一定の食事療法を来院1の8週間以上前から実施している方 ・来院1のHbA1cが6.5%以上10.0%以下の方 |
| 募集期限 | 2011年04月30日 |
【緑内障】1剤点眼中の緑内障患者対象(関西)
| 問い合わせ番号 | 4745 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、これまでに発売されていない新しいタイプの緑内障治療薬として期待されています。すでに緑内障治療薬として発売されておりますPG関連薬やβ遮断薬との併用効果が期待されています。 試験実施時期:2011年11月 参加期間:最大14週間(観察期間:最大6週間 治療期間:8週間) 内容:通院7回 実施施設:大阪市内の眼科施設(2施設) この治験で使用された治験薬は、2014年9月26日に「グラナテック®点眼液0.4%」として販売承認されました。 |
| ご協力いただける方 | 同意取得時の年齢が20歳以上 緑内障で治療されている方、視野障害がないが眼圧値が高く治療されている方 |
| 募集期限 | 2014年04月30日 |
【緑内障】1剤の点眼薬で治療中の方対象(関西)
| 問い合わせ番号 | 4744 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、これまでに発売されていない新しいタイプの緑内障治療薬として期待されています。すでに緑内障治療薬として発売されておりますPG関連薬やβ遮断薬との併用効果が期待されています。 試験実施時期:2011年11月 参加期間:最大14週間(観察期間:最大6週間 治療期間:8週間) 内容:通院7回 実施施設:大阪市内の眼科施設(2施設) この治験で使用された治験薬は、2014年9月26日に「グラナテック®点眼液0.4%」として販売承認されました。 |
| ご協力いただける方 | 緑内障で治療されている方や視野障害なく、眼圧が高い為治療されている方 20歳以上の方 指定する点眼薬を試験が始まる4週間前から使用している方 |
| 募集期限 | 2012年08月31日 |
【緑内障】2ヵ月間の短期通院型試験モニター(関西)
| 問い合わせ番号 | 4743 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、これまでに発売されていない新しいタイプの緑内障治療薬として期待されています。すでに緑内障治療薬として発売されておりますPG関連薬やβ遮断薬との併用効果が期待されています。 試験実施時期:2011年11月 参加期間:最大14週間(観察期間:最大6週間 治療期間:8週間) 内容:通院7回 実施施設:大阪市内の眼科施設(6施設)神戸市内の眼科施設(1施設) この治験で使用された治験薬は、2014年9月26日に「グラナテック®点眼液0.4%」として販売承認されました。 |
| ご協力いただける方 | 緑内障で治療されている方や視野障害なく、眼圧が高い為治療されている方 20歳以上の方 指定する点眼薬を試験が始まる4週間前から使用している方 |
| 募集期限 | 2012年08月31日 |
【緑内障】52週間の長期投与試験(関西)
| 問い合わせ番号 | 4742 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 今回のお薬は、これまでに発売されていない新しいタイプの緑内障治療薬として期待されています。すでに緑内障治療薬として発売されておりますPG関連薬やβ遮断薬との併用効果が期待されています。 試験実施時期:2011年8月 参加期間:52週間 内容:通院17回 実施施設:大阪市内の眼科施設(1施設)大阪府茨木市内の眼科施設(1施設) この治験で使用された治験薬は、2014年9月26日に「グラナテック®点眼液0.4%」として販売承認されました。 |
| ご協力いただける方 | 緑内障で治療されている方または、視野は正常ですが、眼圧が高く治療されている方 年齢が20歳以上の方 |
| 募集期限 | 2013年01月30日 |
【緑内障】点眼治療している緑内障患者向け長期通院型試験(関西)
| 問い合わせ番号 | 4740 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 点眼薬で治療している緑内障患者や高眼圧症患者を対象に行う12ヵ月間の長期通院のご案内です。 12ヶ月間に11回通院いただきます。1ヶ月から1.5ヶ月の間隔で通院いただきます。 ご応募をお待ちしております。 試験開始期間:2010年11月 参加期間:12ヶ月 内容:通院11回 実施施設:大阪市内の眼科施設(2施設)大阪府茨木市内の眼科施設(1施設) この治験で使用された治験薬は、2013年9月20日に「アゾルガⓇ配合懸濁性点眼液」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 緑内障や眼圧が高い高眼圧症で治療されている方 1種類の点眼薬で治療されている方 |
| 募集期限 | 2012年01月25日 |
【緑内障】1剤の点眼薬で治療中の緑内障患者対象(関西)
| 問い合わせ番号 | 4739 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 1剤の点眼薬で治療されている緑内障患者や眼圧が高く1剤の点眼薬で治療されている高眼圧症患者にご協力いただく試験です。 3ヵ月間にたった4回だけ通院する短期通院型試験です。 試験開始時期:2010年11月 参加期間:3ヵ月間 内容:通院4回 実施施設:大阪市内の眼科施設(7施設) 大阪府茨木市内の眼科施設(1施設) 神戸市内の眼科施設(1施設) この治験で使用された治験薬は、2013年9月20日に「アゾルガⓇ配合懸濁性点眼液」として販売承認されました。 |
| ご協力いただける方 | 緑内障で治療している方もしくは眼圧が高く治療している方 20歳以上の男女 本治験で指定する1剤の点眼薬を使用している方 |
| 募集期限 | 2012年09月30日 |
【糖尿病】通院型の長期投与試験(関西)
| 問い合わせ番号 | 2962 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 試験開始時期:2012年8月 参加期間:最大62週間 内容:通院15回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2015年9月28日に「マリゼブⓇ錠12.5mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者の方で以下の治療歴かつ検査数値 ①経口糖尿病治療薬単剤を服用している方:HbA1c6.5%以上9.0%以下 ②食事療法や運動療法のみで治療している方:HbA1c7.0%以上10.0%以下 BMI:18㎏/㎡以上40㎏/㎡未満 |
| 募集期限 | 2014年09月26日 |
【糖尿病】未治療の2型糖尿病患者対象(関東)
| 問い合わせ番号 | 2477 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 2型糖尿病患者を対象に24週間投与した時の安全性と忍容性を検証する内容です。 試験開始時期:2010年7月 参加期間:24週間 内容:通院8回 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者で食事療法及び運動療法のみで治療している方 20歳以上70歳以下 BMIが45.0以下の方 Visit 1a でのHbA1c が次の基準を満たす患者: 経口糖尿病治療薬で治療を受けていない患者:HbA1c が7.0%以上かつ10.0%以下 |
| 募集期限 | 2012年08月31日 |
【糖尿病】長期通院型試験のご案内(関東)
| 問い合わせ番号 | 2473 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 2型糖尿病患者を対象に52週間投与した時の安全性と忍容性を検証する内容です。 試験開始時期:2010年7月 参加期間:52週間 内容:通院17回 実施施設:東京都新宿区 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者で食事療法及び運動療法のみで治療している方もしくは1剤の経口血糖降下剤で治療されている方 20歳以上70歳以下 BMIが18.0以上40.0以下の方 Visit 1a でのHbA1c が次の基準を満たす患者: 経口糖尿病治療薬で治療を受けていない患者:HbA1c が7.0%以上かつ10.0%以下 経口糖尿病治療薬1 剤で治療を受けていた患者:HbA1c が6.5%以上かつ9.0%以下 |
| 募集期限 | 2012年08月16日 |
【脂質異常症】1剤で治療中の方対象通院試験(関東)
| 問い合わせ番号 | 3154 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 試験開始時期:2013年3月 参加期間:約6ヵ月間(26週間) 内容:通院10回 実施施設:東京都新宿区、小金井橋市 この治験で使用された治験薬は、2016年7月4日に「プラルエント®皮下注75mgペン、150mgペン/75mgシリンジ、150mgシリンジ」として販売承認されました。 |
| ご協力いただける方 | ・指定する1剤の治療薬で一定用量を投与されている原発性高コレステロール血症患者でかつ、LDLコレステロールの数値が100㎎/dL以上の方 ・20歳以上75歳以下 ・BMI:18.0以上40.0未満 |
| 募集期限 | 2013年03月04日 |
【男性型脱毛症】男性型脱毛症患者対象の長期投与試験(関西)
| 問い合わせ番号 | 3168 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 男性の男性型脱毛症患者を対象に、治験薬を52週間投与し、安全性及び有効性を評価する内容です。 試験開始時期:2013年4月 参加期間:52週間 実施施設:大阪市淀川区 この治験で使用された治験薬は、2015年9月28日に「ザガーロカプセル0.1mg/05.mg」として販売承認されました。 |
| ご協力いただける方 | 20歳~50歳の男性外来患者 Nowood-Hamilton分類のⅢvertex、ⅣまたはⅤのいづれかの男性型脱毛症のタイプに該当する方 治験期間中は毛髪の色や髪形を変えないなど治験の要件を遵守する意思がある方 |
| 募集期限 | 2014年11月12日 |
【男性型脱毛症】男性型脱毛症患者対象の長期投与試験(関東)
| 問い合わせ番号 | 3156 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 男性の男性型脱毛症患者を対象に、治験薬を52週間投与し、安全性及び有効性を評価する内容です。 試験開始時期:2013年4月 参加期間:52週間 実施施設:東京都新宿区 この治験で使用された治験薬は、2015年9月28日に「ザガーロカプセル0.1mg/05.mg」として販売承認されました。 |
| ご協力いただける方 | 20歳~50歳の男性外来患者 Nowood-Hamilton分類のⅢvertex、ⅣまたはⅤのいづれかの男性型脱毛症のタイプに該当する方 治験期間中は毛髪の色や髪形を変えないなど治験の要件を遵守する意思がある方 |
| 募集期限 | 2014年11月12日 |
【男性型脱毛症】男性型脱毛症患者対象の半年間通院試験(関西)
| 問い合わせ番号 | 2594 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 男性型脱毛症患者を対象に、治験薬を24週間投与し、安全性及び有効性を評価する内容です。 試験開始時期:2010年11月 参加期間:24週間 実施施設:大阪市淀川区 この治験で使用された治験薬は、2015年9月28日に「ザガーロカプセル0.1mg/05.mg」として販売承認されました。 |
| ご協力いただける方 | 20歳~50歳の男性外来患者 Nowood-Hamilton分類のⅢvertex、ⅣまたはⅤのいづれかの男性型脱毛症のタイプに該当する方 治験期間中は毛髪の色や髪形を変えないなど治験の要件を遵守する意思がある方 |
| 募集期限 | 2012年04月12日 |
【副甲状腺機能亢進症】二次性副甲状腺機能亢進症患者対象(関西)
| 問い合わせ番号 | 4731 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 血液透析施行中の二次性副甲状腺機能亢進症患者を対象に1日1回30週間投与した際の有効性及び安全性を検証する内容です。 試験開始時期:2015年8月 参加期間:30週間 内容:通院32回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2018年3月23日に「オルケディア錠1mg、2mg」として販売承認されました。 |
| ご協力いただける方 | 同意取得年齢が20歳以上の方 週3回の血液透析を受ける慢性腎不全患者 |
| 募集期限 | 2017年03月13日 |
【糖尿病】入院試験のご案内(関西)
| 問い合わせ番号 | 234 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 2型糖尿病患者を対象に28日間の投与した時の安全性と忍容性を検証する内容です。 試験開始時期:2009年3月 参加期間:28日間 内容:3泊4日+5泊6日+通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者で食事療法及び運動療法のみで治療している方もしくは1剤の経口血糖降下剤で治療されている方 20歳以上70歳以下 BMIが18.0以上40.0以下の方 |
| 募集期限 | 2009年11月13日 |
【糖尿病】長期通院型試験のご案内(関西)
| 問い合わせ番号 | 2463 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 2型糖尿病患者を対象に52週間投与した時の安全性と忍容性を検証する内容です。 試験開始時期:2010年7月 参加期間:52週間 内容:通院17回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者で食事療法及び運動療法のみで治療している方もしくは1剤の経口血糖降下剤で治療されている方 20歳以上70歳以下 BMIが18.0以上40.0以下の方 Visit 1a でのHbA1c が次の基準を満たす患者: 経口糖尿病治療薬で治療を受けていない患者:HbA1c が7.0%以上かつ10.0%以下 経口糖尿病治療薬1 剤で治療を受けていた患者:HbA1c が6.5%以上かつ9.0%以下 |
| 募集期限 | 2010年07月13日 |
【糖尿病】未治療の2型糖尿病患者対象(関西)
| 問い合わせ番号 | 2464 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 2型糖尿病患者を対象に24週間投与した時の安全性と忍容性を検証する内容です。 試験開始時期:2010年7月 参加期間:24週間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年12月26日に「ジャディアンス10mg/25mg」として販売承認されました。 |
| ご協力いただける方 | 2型糖尿病患者で食事療法及び運動療法のみで治療している方 20歳以上70歳以下 BMIが45.0以下の方 Visit 1a でのHbA1c が次の基準を満たす患者: 経口糖尿病治療薬で治療を受けていない患者:HbA1c が7.0%以上かつ10.0%以下 |
| 募集期限 | 2012年08月13日 |
【緑内障】原発開放隅角緑内障又は高眼圧症患者対象(関西)
| 問い合わせ番号 | 4734 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 原発開放隅角緑内障又は高眼圧症患者を対象とし、治験薬と指定する点眼薬8週間使用し、優越性を検証する内容です。 試験開始時期:2014年4月 参加期間:8週間 内容:通院5回 実施施設:大阪市内の眼科施設(3施設) この治験で使用された治験薬は、2016年9月28日に「ミケルナ配合点眼液」として販売承認されました。 |
| ご協力いただける方 | 年齢:20歳以上80歳以下 両眼とも対象疾患(原発開放隅角緑内障又は高眼圧症)と診断されている方 |
| 募集期限 | 2015年03月13日 |
【緑内障】8週間の比較試験(関西)
| 問い合わせ番号 | 4735 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 原発開放隅角緑内障又は高眼圧症患者を対象とし、治験薬と指定する点眼薬8週間使用し、優越性を検証する内容です。 試験開始時期:2014年4月 参加期間:8週間 内容:通院5回 実施施設:大阪市内の眼科施設(6施設)、茨木市の眼科施設(1施設)、神戸市北区の眼科施設(1施設) この治験で使用された治験薬は、2016年9月28日に「ミケルナ配合点眼液」として販売承認されました。 |
| ご協力いただける方 | 年齢:20歳以上80歳以下 両眼とも対象疾患(原発開放隅角緑内障又は高眼圧症)と診断されている方 |
| 募集期限 | 2015年03月13日 |
【副甲状腺機能亢進症】52週間の長期投与試験のご案内(関西)
| 問い合わせ番号 | 4733 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 血液透析下の二次性副甲状腺機能亢進症患者に対し、観察期(4週間)と治療期(52週間)で、長期投与時の安全性と忍容性及び有効性について検討する内容です。 試験開始時期:2014年10月 参加期間:52週間 内容:通院33回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2016年12月19日に「パーサビブ静注透析用2.5mg/パーサビブ静注透析用5mg/パーサビブ静注透析用10mg」として販売承認されました。 |
| ご協力いただける方 | 同意取得時の年齢が20歳以上 二次性副甲状腺機能亢進症を合併した慢性腎不全で治療を受けている方 観察期開始時の90 日以上前から週3 回の血液透析を受けている方 |
| 募集期限 | 2016年08月13日 |
【美容モニター】使用感評価試験モニター(関西)
| 問い合わせ番号 | 4721 |
|---|---|
| 実施地区 | |
| 説明 | 30歳~50歳代の女性にご協力いただき、試作品を使用いただき、使用感を比較評価していただく内容です。 試験開始時期:2020年3月 内容:Webアンケートのみ 実施エリア:関西 |
| ご協力いただける方 | 30歳~50歳代の女性 日常的なスキンケア、ボディケアにオイル型の商品を使用している方 顔を含めた使用部位に皮膚疾患を有さない方 市販の化粧品にて肌トラブルの経験を有さない方 |
| 募集期限 | 2020年03月10日 |
【アンケートモニター】110名の方に参加頂くアンケートモニター試験(関西)
| 問い合わせ番号 | 4705 |
|---|---|
| 実施地区 | |
| 説明 | 40歳以上の男性と女性の方を対象に「一般生活者を対象とした治療参画に関するアンケート調査」に協力いただく内容です。 試験開始時期:2020年2月 内容:通院1回 実施施設:大阪市淀川区 |
| ご協力いただける方 | 40歳以上の男性と女性 緑内障の治療をされていない方 医療従事者でない方 |
| 募集期限 | 2020年02月21日 |
【美容モニター】男性型脱毛症の方対象の試験モニターのご案内(関東)
| 問い合わせ番号 | 4722 |
|---|---|
| 実施地区 | |
| 説明 | 男性型脱毛症が気になる方で、緒方の分類でⅡ又はⅣの初期~末期に該当する方にご協力いただきます。 育毛剤の塗布による育毛効果を評価するためにマイクロスコープによる局所毛髪処理部位の撮影、頭部デジタル写真撮影、専門家による洗髪、自覚症状アンケートを行います。 参加開始時期:2019年12月 参加期間:8ヵ月間 内容:通院10回 |
| ご協力いただける方 | ・関東地区在住 ・同意取得時の年齢が20歳以上60歳以下の日本人男性 ・男性型脱毛症が気になる方 ・緒方の分類でⅡ又はⅣの初期~末期に該当する方 ・頭頂部に約1.5㎝×約1.5㎝(約2平方センチメートル領域で約1mmの長さ)の局所毛髪処理に同意可能な方 |
| 募集期限 | 2020年03月13日 |
【花粉症】スギ花粉による鼻炎症状のある方(関東)
| 問い合わせ番号 | 3697 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 参加開始時期:2016年2月 参加期間:約2週間 内容:通院4回程度 実施施設:東京都新宿区、東京都小金井橋市 この治験で使用された治験薬は、2018年1月19日に「アレサガテープ4mg・アレサガテープ8mg」として販売承認されました。 |
| ご協力いただける方 | 年齢16歳以上65歳未満(男女不問)で、以下の条件に該当する方 ※但し、未成年については、必ず親権者と一緒に通院できる方のみ参加可 ①2年以上前からスギ花粉飛散時期に鼻炎症状(鼻づまり、鼻水、くしゃみ)がある方 ②一定期間(治験開始1週間前から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 |
| 募集期限 | 2016年08月31日 |
【入りやすさ◎!! 1/27(金)入院開始】(4泊5日+通院4回)×2回セット
| 問い合わせ番号 | 4008 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2017年1月 内容:(4泊5日+通院4回)×2回セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年2月23日に「ゾフルーザ錠10mg・ゾフルーザ錠20mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳から39歳までの健康な日本人 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2017年01月26日 |
【糖尿病】8月に始まる長期通院試験(関西)
| 問い合わせ番号 | 3278 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2014年8月 参加期間:約15ヵ月間 内容:通院12回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2018年3月23日に「オゼンピック皮下注2mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)で、以下の条件に該当する方 運動療法・食事療法のみで血糖コントロールを行っており、 ヘモグロビンA1c(HbA1c:NGSP)が7.0%以上10.5%以下 |
| 募集期限 | 2014年12月20日 |
【糖尿病】2014年1月に始まる通院試験(関西)
| 問い合わせ番号 | 3277 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2014年2月 参加期間:約9ヵ月間 内容:通院9回 参加施設:大阪府吹田市 この治験で使用された治験薬は、2018年3月23日に「オゼンピック皮下注2mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)で、以下の条件に該当する方 運動療法・食事療法のみで血糖コントロールを行っており、 ヘモグロビンA1c(HbA1c:NGSP)が7.0%以上10.0%以下 |
| 募集期限 | 2014年03月31日 |
大募集中!!GWを利用しての3泊4日2回セット【4/22(金)入院開始】
| 問い合わせ番号 | 3843 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2016年3月 内容:3泊4日2回セット 参加施設:大阪市淀川区 この治験で使用された治験薬は、2017年8月15日に「オルメサルタン錠5mg「ニプロ」・オルメサルタン錠10mg「ニプロ」・オルメサルタン錠20mg「ニプロ」・オルメサルタン錠40mg「ニプロ」」として販売承認されました。 |
| ご協力いただける方 | ・20歳から35歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 ※まだまだ枠に余裕があります! |
| 募集期限 | 2016年04月20日 |
【40歳の方まで参加できる11月実施の宿泊試験】3泊4日3回セット+通院1回
| 問い合わせ番号 | 3468 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2014年8月 内容:3泊4日3回セット+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2017年8月16日に「リクシアナOD錠15mg/リクシアナOD錠30mg/リクシアナOD錠60mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳から40歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・体重が50.0kg以上の方 ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2014年08月18日 |
9月開始の一番長い試験です!【9/16(水)入院開始治験】5泊6日2回セット+通院11回
| 問い合わせ番号 | 3651 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2015年8月 内容:5泊6日2回セット+通院11回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年1月19日に「エタネルセプトBS皮下注用10mg「MA」/エタネルセプトBS皮下注用25mg「MA」」として販売承認されました。 |
| ご協力いただける方 | ・20歳から40歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2015年09月09日 |
年内に終わる試験!!【12/4(日)入院開始】7泊8日2セット
| 問い合わせ番号 | 3986 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2016年11月 内容:7泊8日2セット 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年2月15日に「フェンタニル3日用テープ2.1mg「トーワ」」として販売承認されました。 |
| ご協力いただける方 | ・20歳から39歳までの健康な日本人 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2016年12月03日 |
【40歳の方まで参加できる1月実施試験 その①】3泊4日2回セット+通院1回
| 問い合わせ番号 | 3537 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2014年12月 内容:3泊4日2回セット+通院1回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年8月10日に「エフィエントOD錠20mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳から40歳までの健康な日本人男性 ・BMIが18.5以上24.9以下の方 *BMI=身長÷(体重×体重)* ・関西圏にお住まいの方 ・健康診断の結果により、医師が治験参加可と判断した方 ・所定の宿泊期間にご参加いただける方 |
| 募集期限 | 2015年01月11日 |
【花粉症】関東地区限定!2月から開始の短期通院試験
| 問い合わせ番号 | 3436 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 通年性及び季節性アレルギー性鼻炎患者を対象とした長期投与試験のご案内です。 参加開始時期:2015年2月 参加期間:約3ヵ月間(最大1年間まで) 内容:通院6回(最大16回まで) 実施施設:東京都新宿区 この治験で使用された治験薬は、2016年9月28日に「ビラノア錠20mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上64歳以下(男女不問)の方で、以下の条件に該当する方 ①スギ花粉飛散時期に鼻炎症状(鼻づまり、鼻水、くしゃみ)がある方 ②一定期間(治験開始2週間前から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 |
| 募集期限 | 2015年02月28日 |
【ワクチン】3月よりスタート 通院試験(関西)
| 問い合わせ番号 | 3339 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 参加開始時期:2014年3月 参加期間:約3ヵ月間 内容:通院4回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年3月18日に「乾燥弱毒生水痘ワクチン「ビケン」」として販売承認されました。 |
| ご協力いただける方 | ・50歳から79歳までの日本人成人(男女) ・治療中の方で、症状が安定している方もご参加いただけます ・関西圏にお住まいの方 ・健康診断の結果より参加可能で、かつ定められた通院日程に来院できる方 |
| 募集期限 | 2014年04月26日 |
【インフルエンザ】インフルエンザ感染症患者を対象通院型治験(関西)
| 問い合わせ番号 | 4000 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 12歳以上64 歳以下の男性及び女性で,発症後48 時間以内のA 型及び/又はB 型インフルエンザ患者対象に2種類の異なる薬剤を投与し、安全性と有効性を検証する内容です。 参加開始時期:2016年10月 内容:発症後通院7回 実施施設:大阪市淀川区 この治験で使用された治験薬は、2018年2月23日に「ゾフルーザ錠10mg/ゾフルーザ錠20mg」として販売承認されました。 |
| ご協力いただける方 | ・12歳以上64 歳以下の男性及び女性で,発症後48 時間以内のA 型及び/又はB 型インフルエンザ患者 ・投与前検査時点又は解熱薬投与 (使用した場合) から4 時間超が経過した時点で38℃以上の発熱 (腋窩温) がある方 ・インフルエンザウイルス感染症による以下の全身症状のうち,中等度以上の症状を1 項目以上有する方 - 頭痛 - 熱っぽさ又は悪寒 - 筋肉又は関節の痛み - 疲労感 |
| 募集期限 | 2017年05月01日 |
【気管支喘息】吸入ステロイドを使用中の喘息患者対象(関西)
| 問い合わせ番号 | 3522 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 吸入ステロイドや気管支拡張剤を使用しているが、コントロール不良で増悪傾向にある喘息症状のある方を対象に、60週間の長期通院型治験の御案内です。 参加開始時期:2013年7月 参加期間:15ヵ月間 内容:通院20回(4週間毎) この治験で使用された治験薬は、2018年1月19日に「ファセンラ皮下注30mgシリンジ」として販売承認されました。 |
| ご協力いただける方 | ・Visit1の時点で20歳以上75 歳以下の男女 ・体重が40 kg 以上の方 ・Visit1の来院前12 ヵ月以上、中用量又は高用量のICS、及びLABA が必要と診断された方 |
| 募集期限 | 2014年12月28日 |
【花粉症】関西地区限定!初夏から開始 長期通院試験
| 問い合わせ番号 | 3462 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 通年性及び季節性アレルギー性鼻炎患者を対象とした長期投与試験のご案内です。 参加開始時期:2014年8月 参加期間:約3ヵ月間(最大1年間まで) 内容:通院6回(最大16回まで) 実施施設:大阪市淀川区 この治験で使用された治験薬は、2016年9月28日に「ビラノア錠20mg」として販売承認されました。 |
| ご協力いただける方 | 年齢20歳以上64歳以下(男女不問)の方で、以下の条件に該当する方 ①季節を問わず年中鼻炎症状(鼻づまり、鼻水、くしゃみ)がある方 ②一定期間(治験開始2週間前から終了まで)、治験薬以外の鼻炎治療薬など治験薬の評価に影響がある薬剤について、使用を制限できる方 ③女性の場合は、閉経している方もしくは適切な避妊を実施いただける方 |
| 募集期限 | 2014年09月20日 |
【健康成人】健康成人男性対象の単回投与試験(関西)
| 問い合わせ番号 | 2938 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性を対象に、5泊6日の入院を3回参加いただき、入院期間中に指定された薬剤(錠剤タイプ)を服用していただき、それぞれ異なるお薬の比較検証する内容です。 参加開始時期:2012年1月 内容:5泊6日×3 実施施設:大阪府吹田市 この治験で使用された治験薬は、2014年3月24日に「ルセフィR錠2.5mg/ルセフィR錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上40歳未満の日本人健康成人男性 ・スクリーニング検査実施日のBMIが18.5 kg/m2以上25.0kg/m2未満の方 |
| 募集期限 | 2012年06月30日 |
【健康成人】健康成人男性対象の反復投与試験(関西)
| 問い合わせ番号 | 2505 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性を対象に、3泊4日の入院を3回参加いただき、入院期間中に指定された薬剤(錠剤タイプ)を服用していただき、それぞれ異なるお薬の比較検証する内容です。 参加開始時期:2010年8月 内容:3泊4日×3 実施施設:大阪市淀川区 この治験で使用された治験薬は、2014年3月24日に「ルセフィ®錠2.5mg/ルセフィ®錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・日本人健康成人男性で同意取得時の年齢が20歳以上40歳未満の方 ・スクリーニング検査実施日のBMIが18.5 kg/m2以上25.0 kg/m2未満の方 |
| 募集期限 | 2010年12月31日 |
【糖尿病】1剤で治療中の2型糖尿病患者対象の長期投与試験(関東)
| 問い合わせ番号 | 273 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 1剤で治療中の2型糖尿病患者を対象に、長期通院型治験のご案内です。治験期間中はご自身で注射を行っていただく内容となります。 参加開始時期:2009年5月 参加期間:14ヶ月間 内容:通院20回 実施施設:東京都新宿区 この治験で使用された治験薬は、2013年6月28日に「リキスミアⓇ」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病と診断さている方 ・指定する薬剤以外の糖尿病治療薬の投与を受けていない方 ・スクリーニング時点のHbA1c7.0%以上10.0%未満 ・スクリーニング時点の年齢が20歳以上の方 |
| 募集期限 | 2011年01月22日 |
【糖尿病】1剤で治療中の2型糖尿病患者対象の長期投与試験(関西)
| 問い合わせ番号 | 281 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 1剤で治療中の2型糖尿病患者を対象に、長期通院型治験のご案内です。治験期間中はご自身で注射を行っていただく内容となります。 参加開始時期:2009年5月 参加期間:14ヶ月間 内容:通院20回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2013年6月28日に「リキスミアⓇ」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病と診断さている方 ・指定する薬剤以外の糖尿病治療薬の投与を受けていない方 ・スクリーニング時点のHbA1c7.0%以上10.0%未満 ・スクリーニング時点の年齢が20歳以上の方 |
| 募集期限 | 2011年01月22日 |
【糖尿病】2型糖尿病の方対象の入院試験(関西)
| 問い合わせ番号 | -4604 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 2型糖尿病の方を対象に、現在治療でご使用されている経口血糖降下剤に加え、今回の治験薬を使用いただき、効果と安全性を検証する試験です。 参加開始時期:2006年11月 参加期間:2ヵ月間 内容:通院5回、2泊3日×1回、1泊2日×3回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2013年6月28日に「リキスミアⓇ」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病と診断されている方 ・20歳以上75歳以下の男女 ・指定日に来院及び入院が可能な方 ・来院1の時点のBMIが35Kg/㎡以下の方 ・来院1の時点のHbA1cが7.0%以上10.0%以下の方 |
| 募集期限 | 2007年09月16日 |
【糖尿病】2型糖尿病患者対象の長期投与試験(関東)
| 問い合わせ番号 | 2470 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 血糖降下薬単剤投与による治療にもかかわらず血糖コントロールが不十分な2 型糖尿病患者を対象に安全性と有効性を検証する長期投与試験のご案内です。 参加開始時期:2010年8月 参加期間:12ヵ月間 内容:通院17回 実施施設:東京都新宿区 この治験で使用された治験薬は、2013年3月25日に「トラゼンタ錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病の診断を受けている男女 ・食事療法及び運動療法を実施中でかつ、経口血糖降下薬1剤による治療を受けている方 ・Visit1での検査にて、HbA1cが7.0%以上10.5%以下 ・Visit1での検査にて、BMIが40以下の方 |
| 募集期限 | 2012年03月03日 |
【糖尿病】2型糖尿病患者対象の長期投与試験(関西)
| 問い合わせ番号 | 2462 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 血糖降下薬単剤投与による治療にもかかわらず血糖コントロールが不十分な2 型糖尿病患者を対象に安全性と有効性を検証する長期投与試験のご案内です。 参加開始時期:2010年8月 参加期間:12ヵ月間 内容:通院17回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2013年3月25日に「トラゼンタ錠5mg」として販売承認されました。 |
| ご協力いただける方 | ・2型糖尿病の診断を受けている男女 ・食事療法及び運動療法を実施中でかつ、経口血糖降下薬1剤による治療を受けている方 ・Visit1での検査にて、HbA1cが7.0%以上10.5%以下 ・Visit1での検査にて、BMIが40以下の方 |
| 募集期限 | 2012年03月03日 |
【健康成人】健康成人男性対象の同等性試験(関西)
| 問い合わせ番号 | 291 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性を対象に、4泊5日の入院を2回参加いただき、入院期間中に指定された薬剤(錠剤タイプ)を服用していただき、それぞれ異なるお薬の比較検証する内容です。 参加開始時期:2009年7月 内容:4泊5日×2 実施施設:大阪市淀川区 この治験で使用された治験薬は、2012年6月29日に「テネリア®錠20mg」として販売承認されました。 |
| ご協力いただける方 | ・健康な日本人男性 ・同意取得時の年齢が20歳以上46歳未満 |
| 募集期限 | 2009年10月03日 |
【健康成人】健康成人男性対象の同等性試験(関西)
| 問い合わせ番号 | 274 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 健康な日本人男性を対象に、4泊5日の入院を2回参加いただき、入院期間中に指定された薬剤(錠剤タイプ)を服用していただき、それぞれ異なるお薬の比較検証する内容です。 参加開始時期:2009年6月 内容:4泊5日×2 実施施設:大阪市淀川区 この治験で使用された治験薬は、2011年7月1日に「リオベル配合錠LD/リオベル配合錠HD」として販売承認されました。 |
| ご協力いただける方 | ・健康な日本人男性 ・同意取得時の年齢が20歳以上35歳以下の方 ・スクリーニング検査時の体重が50.0㎏以上の方 ・スクリーニング検査時のBMIが18.5以上25.0未満の方 |
| 募集期限 | 2009年10月03日 |
【医療機器モニター】コンタクトレンズモニター試験(関東)
| 問い合わせ番号 | 4638 |
|---|---|
| 実施地区 | |
| 説明 | 視力補正が必要な近視又は近視性乱視眼を有する方に対して、治験用のコンタクトレンズを2週間交換(終日装用)で使用した場合の安全性及び有効性を評価する内容です。 参加開始時期:2019年11月 参加期間:3ヵ月間 内容:通院5回 |
| ご協力いただける方 | ・関東在住 ・20歳以上の男女 ・両眼に視力矯正が必要な近視又は近視性乱視眼を有する方 |
| 募集期限 | 2019年11月30日 |
【糖尿病】1剤で治療中の方対象の12週間、6回通院(関西)
| 問い合わせ番号 | 68 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 2型糖尿病患者を対象に、治験薬と指定する糖尿病治療薬の併用療法による有効性と安全性を検証する試験のご案内です。 参加開始時期:2008年8月 参加期間:4ヵ月間 内容:通院6回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2011年1月21日に「ソニアス配合錠LD/HD」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の男女 ・HbA1c7.0以上10.0未満 ・治験参加の4週間前から食事療法、運動療法を実施している方 ・治験参加の4週間前から糖尿病1剤で治療している方 |
| 募集期限 | 2009年03月31日 |
【糖尿病】指定する1種類の薬剤で治療中の方対象(関西)
| 問い合わせ番号 | 67 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 食事療法、運動療法に加え、SU剤を使用していても血糖コントロールが不十分な2型糖尿病患者にご協力いただく治験のご案内です。 参加開始時期:2008年8月 参加期間:6ヵ月間 内容:通院8回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年4月16日に「ネシーナ錠25mg/ネシーナ錠12.5mg/ネシーナ錠6.25mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の男女 ・2型糖尿病と診断されている方 ・治験開始の4週間以上前からSU剤を使用している方 ・HbA1c7.0以上10.0未満 ・食事療法もしくは運動療法を実施している方 |
| 募集期限 | 2010年02月28日 |
【糖尿病】未治療の方対象に20週間、7回通院試験(関西)
| 問い合わせ番号 | -4569 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 糖尿病の治療薬を使用せず、運動療法や食事療法のみで治療されている方を対象に、お薬の安全性と効果を検証する試験のご案内です。 治験薬を服用しない8週間と治験薬を服用する12週間の計20週間の間に、2~4週間ごとに計7回通院頂く内容です。 参加開始期間:2007年1月 参加期間:5ヵ月間 内容:通院7回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年4月16日に「ネシーナ錠25mg/ネシーナ錠12.5mg/ネシーナ錠6.25mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の方 ・HbA1c6.5以上10.0未満 ・糖尿病の治療薬を使用していない方 ・食事療法及び運動療法を継続して実施している方 |
| 募集期限 | 2008年02月01日 |
【糖尿病】未治療の方対象に20週間、7回通院試験(関東)
| 問い合わせ番号 | -4345 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 糖尿病の治療薬を使用せず、運動療法や食事療法のみで治療されている方を対象に、お薬の安全性と効果を検証する試験のご案内です。 治験薬を服用しない8週間と治験薬を服用する12週間の計20週間の間に、2~4週間ごとに計7回通院頂く内容です。 参加開始期間:2007年1月 参加期間:5ヵ月間 内容:通院7回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年4月16日に「ネシーナ錠25mg/ネシーナ錠12.5mg/ネシーナ錠6.25mg」として販売承認されました。 |
| ご協力いただける方 | ・20歳以上の方 ・HbA1c6.5以上10.0未満 ・糖尿病の治療薬を使用していない方 ・食事療法及び運動療法を継続して実施している方 |
| 募集期限 | 2008年02月01日 |
【糖尿病】未治療で、食事療法または運動療法を実施している方(関西)
| 問い合わせ番号 | -4663 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 糖尿病治療薬を12週間服用していただき、効果と安全性を検証する試験のご案内です。 参加開始時期:2006年7月 参加期間:3ヵ月間 内容:通院6回 実施施設:大阪府吹田市 この治験で使用された治験薬は、2010年1月20日に「エクア錠50mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 糖尿病の治療薬を使用していない方 食事療法や運動療法を継続的に実施していただける方 指定する日時に来院可能な方 |
| 募集期限 | 2006年04月07日 |
【糖尿病】未治療で、食事療法または運動療法を実施している方(関東)
| 問い合わせ番号 | -4354 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 糖尿病治療薬を12週間服用していただき、効果と安全性を検証する試験のご案内です。 参加開始時期:2006年7月 参加期間:3ヵ月間 内容:通院6回 実施施設:東京都新宿区 この治験で使用された治験薬は、2010年1月20日に「エクア錠50mg」として販売承認されました。 |
| ご協力いただける方 | 20歳以上の男女 糖尿病の治療薬を使用していない方 食事療法や運動療法を継続的に実施していただける方 指定する日時に来院可能な方 |
| 募集期限 | 2006年07月24日 |
【美容モニター】 男性限定 男性用化粧品モニター(関東)
| 問い合わせ番号 | 4686 |
|---|---|
| 実施地区 | |
| 説明 | UVカットの男性用化粧品の使用感調査のために、背景・嗜好アンケート、使用感アンケート、香りアンケート、肌色・日焼けアンケートを行う試験です。 参加開始時期:2020年1月 内容:来院1回 |
| ご協力いただける方 | ・関東在住の方 ・同意取得時の年齢が20歳以上25歳以下の日本人男性 ・来所当日、香水、香りの強い化粧品をつけず、さらに腕には何も塗布をせずに来所することに同意可能な方 ・次の身だしなみケアアイテムについて、これまでに1つでも使用した経験がある方 制汗剤・デオドラント剤 .汗拭きシート .ヘアトニック .香水・フレグランス .UVケア用品 .顔用の化粧水 .顔用の乳液・クリーム .ボディ用のローション .ボディ用の乳液・クリーム .ハンドクリーム |
| 募集期限 | 2020年01月27日 |
【サプリメントモニター】滋養強壮サプリメントモニター試験のご案内(関西)
| 問い合わせ番号 | 4382 |
|---|---|
| 実施地区 | |
| 説明 | 最近発売された病院向けサプリメントを8週間摂取していただいた際の効果を検証するモニター試験となります。 このサプリメントの主成分は、精子の運動を活発にする効果が期待されており、男性の不妊治療のサポートとしての役割も期待されております。 参加開始時期:2018年9月 参加期間:3ヵ月間 内容:通院3回 |
| ご協力いただける方 | ・35歳以上45歳未満の男性 ・BMIが18.5以上25.0未満の方 ・アルコールの摂取量の1日平均量が20g以下の方 ・試験開始3ヵ月前よりサプリメントを常用していない方 ・試験期間中3回ご自宅で精液を採取し提供いただける方 ※その他にも本モニターにご参加いただけない条件がいくつかあります。 |
| 募集期限 | 2018年09月01日 |
【医療機器モニター】カラーコンタクトレンズのつけ心地調査(関西)
| 問い合わせ番号 | 4645 |
|---|---|
| 実施地区 | |
| 説明 | 現在カラーコンタクトレンズを使用されている方を対象に、カラーコンタクトレンズのつけ心地調査を行うモニター試験です。 大阪の梅田駅近くの指定する眼科にて、通院頂く内容です。 治験参加期間:2017年5月 内容:通院2回 |
| ご協力いただける方 | 現在カラコンを週1日以上使用している方 同意取得時の年齢が20歳以上40歳未満 矯正視力1.0以上 極端な乱視が無い方 試験期間中支給されるコンタクトを毎日装着できる方 試験期間中に妊娠中、授乳中でない方 |
| 募集期限 | 2017年06月01日 |
【美容モニター】シワやたるみが気になる女性の方対象の化粧品モニター(関東)
| 問い合わせ番号 | 4637 |
|---|---|
| 実施地区 | |
| 説明 | 目尻のシワや頬・フェイスラインのたるみが気になる方を対象に指定の化粧品を12週間使用していただき、肌の評価をする試験となります。 今回はクレンジング、洗顔、ローション、エッセンス、ゲルの5品の化粧品をご使用いただきます。 参加開始時期:2019年9月 参加期間:4ヵ月間 内容:通院4回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・35歳~49歳の女性の方で、シワグレードが基準に収まっている方が対象になります。 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 ・期間中簡単なマッサージを併用いただける方。 ・期間中の基礎ケアは試験品の5品のみを使用いただける方。 ※UV製品とメイクアップ製品はお手持ちのものを使用いただけます。 |
| 募集期限 | 2019年09月18日 |
【健康食品モニター】果汁飲料を摂取する食品モニター(関東)
| 問い合わせ番号 | 4636 |
|---|---|
| 実施地区 | |
| 説明 | 健康食品メーカーが発売する果汁ジュースを12週間摂取いただき、血圧・採血・採尿を実施しデータを評価する食品モニター試験のご案内です。 参加開始時期:2019年9月 参加期間:4ヵ月間 内容:通院4回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・20歳~65歳以下の男女 ・BMIが23以上30未満 |
| 募集期限 | 2019年09月10日 |
【美容モニター】目尻のシワが気になる方対象の化粧品モニター(関東)
| 問い合わせ番号 | 4565 |
|---|---|
| 実施地区 | |
| 説明 | 目尻のシワが気になる方を対象に指定の美容液を4週間使用していただく化粧品モニター試験のご案内です。 目尻の撮影とアンケートにご協力いただきます。 参加開始時期:2019年6月 参加期間:2ヵ月間 内容:通院2回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・35歳~59歳の女性の方で、シワグレードが一定の基準に収まっている方が対象になります。 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2019年06月04日 |
【美容モニター】目尻のシワが気になる女性の方対象(関東)
| 問い合わせ番号 | 4564 |
|---|---|
| 実施地区 | |
| 説明 | 目尻のシワが気になる方を対象に指定の保湿美容液を4週間使用していただき、肌の評価をする化粧品モニター試験のご案内です。 目尻の撮影とアンケートにご協力いただきます。 参加開始時期:2019年5月 参加期間:2ヵ月間 内容:通院2回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・35歳~59歳の女性の方で、シワグレードが一定の基準に収まっている方が対象になります。 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2019年05月30日 |
【美容モニター】目尻のシワが気になる方を対象の化粧品モニター試験(関東)
| 問い合わせ番号 | 4563 |
|---|---|
| 実施地区 | |
| 説明 | 目尻のシワが気になる方を対象に指定の化粧品を4週間使用していただき、肌の評価をする化粧品モニターのご案内です。 目尻のシワの撮影と簡単なアンケートにお答えいただきます。 参加開始時期:2019年7月 参加期間:2ヵ月間 内容:通院2回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・35歳~59歳の女性の方で、シワグレードが一定の基準に収まっている方が対象になります。 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2019年07月05日 |
【美容モニター】お肌のシワやくすみが気になる方(関東)
| 問い合わせ番号 | 4503 |
|---|---|
| 実施地区 | |
| 説明 | お肌のシワやくすみが気になる方を対象に既に市販されている国産オーガニック美容液を4週間ご使用いただく化粧品モニターのご案内です。 参加開始時期:2019年3月 参加期間:2ヵ月間 内容:通院2回 ※都内で実施致します。 |
| ご協力いただける方 | ・関東在住 ・モニター試験期間中に日焼けする予定のない方 ・30歳~59歳の女性の方で、シワグレード分類が2~3の方 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2019年04月14日 |
【サプリメントモニター】脂肪燃焼効果が期待されるサプリメントモニター
| 問い合わせ番号 | 4455 |
|---|---|
| 実施地区 | 東京 |
| 説明 | 脂肪燃焼効果が期待されるサプリメントモニターのご案内 ~~こんな方におススメ~~ ・痩せたいけど自分だけではなかなか痩せられない方 ・忙しくなかなか運動ができず痩せられない方 参加開始時期:2019年2月 参加期間:3ヵ月 内容:通院4回 ※試験期間中、食事や体重、歩数を記入する日誌をつけて頂きます。 |
| ご協力いただける方 | ・20歳以上59歳以下の健常な男女 ・BMIが23kg/㎡以上の方30kg/㎡未満の方 ※BMI=体重(㎏)÷[身長(m)X身長(m)] ・日常生活において、日頃から過度な運動をしない方 |
| 募集期限 | 2019年02月16日 |
【美容モニター】汗をかきやすい女性の方を対象の化粧品モニター試験(関東)
| 問い合わせ番号 | 4466 |
|---|---|
| 実施地区 | |
| 説明 | 汗をかきやすい女性の方を対象に、1か月間制汗コスメを使用いただき効果を検証するモニターです。 参加開始時期:2019年1月 内容:通院2回 実施場所:都内 所要時間:約1時間 |
| ご協力いただける方 | ・関東在住 ・20歳~49歳の女性 |
| 募集期限 | 2019年01月31日 |
【美容モニター】目尻のシワが気になる女性を対象の化粧品モニター(関東)
| 問い合わせ番号 | 4441 |
|---|---|
| 実施地区 | |
| 説明 | 最近目尻のシワが来なっている女性が対象の化粧品モニター試験のご案内です。 指定の化粧品を4週間使用していただき、左右目尻シワの撮影と簡単なアンケートにお答えいただく内容です。 参加開始時期:2018年12月 参加期間:1ヵ月間 内容:通院2回 |
| ご協力いただける方 | ・関東在住 ・35歳~59歳の女性の方で、シワグレード分類が2~3の方 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2018年12月25日 |
【美容モニター】目尻のシワでお困りの女性対象の化粧品モニター試験(関東)
| 問い合わせ番号 | 4445 |
|---|---|
| 実施地区 | |
| 説明 | 最近目尻のシワでお困りの女性を対象に指定の美容クリームを4週間使用していただき、効果について検証する化粧品モニター試験となります。 東京都内で実施し、目尻のシワの撮影とアンケートにご協力いただく内容です。 治験開始時期:2018年11月 内容:通院2回 |
| ご協力いただける方 | 関東在住の方 35歳~59歳の女性の方で、シワグレード分類が2~3の方 ※シワグレードの判定は日本香粧品学会化粧品機能評価法ガイドラインをご参照ください。 |
| 募集期限 | 2018年11月30日 |
【美容モニター】目尻の小ジワが気になる男性を対象の化粧品モニター(関東)
| 問い合わせ番号 | 4669 |
|---|---|
| 実施地区 | |
| 説明 | 目尻のシワの写真撮影、皮膚の水分量、皮膚の弾力性などの測定を週末の日程で8週間ご協力いただく男性用化粧品モニターです。 参加開始時期:2019年12月 参加期間:4ヵ月間 内容:通院4回 |
| ご協力いただける方 | ・関東地区在住の方 ・年齢35歳以上50歳以下の日本人男性 ・普段のスキンケアにおいて、何もしていない、または、化粧水のみでケアを行っている方 |
| 募集期限 | 2019年12月13日 |
【治療抵抗性うつ病】治療中の方対象の長期投与試験(関東)
| 問い合わせ番号 | 4689 |
|---|---|
| 実施地区 | |
| 説明 | 『いくつかの抗うつ薬を飲み続けているが、うつ症状が治ったりまた出たり…』と、症状が改善されない治療抵抗性うつ病の方を対象とした治験のご案内です。 以下の①~④のような症状が当てはまる方、ご参加をご検討ください。 ①数種類の抗うつ薬を飲み続けている ②疲労感や倦怠感があり、やる気が出ない ③症状が緩和したり悪化したりする ④今の治療法に満足していない。 参加開始時期:2018年11月 参加期間:10ヵ月間 内容:通院タイプと入院タイプの試験がございます。 |
| ご協力いただける方 | ・関東在住の方 ・同意説明文書へ署名する時点で20 歳以上64 歳以下の日本人男女 ・抗うつ剤を1剤以上使用している方 |
| 募集期限 | 2019年06月01日 |
【顕微鏡的多発血管炎(MPA)】診断のある方対象の長期投与試験
| 問い合わせ番号 | 4687 |
|---|---|
| 実施地区 | |
| 説明 | 顕微鏡的多発性血管炎(MPA)と診断された方を対象とした治験です。 従来の治療では治りにくい神経障害のある顕微鏡的多発血管炎の方を対象に、治験薬が神経障害に効果があるかどうか有効性や安全性を調べます。 参加開始時期:2019年10月 参加期間:5ヵ月間 内容:点滴注射を受けていただきます。 実施地域:東北、関東、東海、関西、中国、四国、九州 |
| ご協力いただける方 | ・顕微鏡的多発性血管炎と診断されている20歳以上の方 ・従来の治療(副腎皮質ステロイド剤による治療)では治りにくい神経障害のある方 |
| 募集期限 | 2019年12月01日 |
【全身性エリテマトーデス(SLE)】長期投与通院型試験モニター
| 問い合わせ番号 | 4671 |
|---|---|
| 実施地区 | |
| 説明 | 1剤以上の標準的な治療を行っても、症状が十分に改善されない全身性エリテマトーデス(SLE)の方を対象に治験薬の有効性や安全性を確認する治験となります。 薬を服用しても十分な改善が見られない、現在の薬で満足する効果が得られないとお悩みの方が対象となります。 参加開始時期:2019年6月 参加期間:12ヵ月間 通院:24回 実施地区:北海道・東北・関東・中部・関西・中国・九州 |
| ご協力いただける方 | ・年齢16歳~75歳までの日本人の方 ・少なくとも3か月以上前にSLEと診断されている方 ・全身性エリテマトーデス(SLE)の治療をしても十分な改善がみられない方 ※その他条件有。ご予約時に詳しく確認させていただきます。 |
| 募集期限 | 2019年11月01日 |
【美容モニター】サプリメントの摂取による肌症状改善の評価試験モニター(関東)
| 問い合わせ番号 | 4666 |
|---|---|
| 実施地区 | |
| 説明 | 肌荒れや肌のかさつき、肌のたるみなど肌トラブルを感じる男性の方に、サプリメントの摂取による皮膚の弾力性、皮膚の水分量、皮膚の水分蒸発量などの測定を行う食品モニターです。 参加開始時期:2019年12月 参加期間:5ヵ月間 内容:通院5回 |
| ご協力いただける方 | ・関東地区在住の方 ・同意取得時の年齢が30歳以上50歳以下の日本人男性 ・肌のたるみを感じる方、肌のかさつきを感じる方、肌荒れを自覚している方 ・毎年、10月から3月にかけて、右頬部、右頸部、上背部、右脛部、右足背部のいずれかに、乾燥などによる肌荒れを自覚している者、または、かゆみの症状が認められる者(落屑がある場合が望ましい)、または、入浴後などに白い粉吹きが認められる方 ・手先や顔の冷えを感じる方 ・生活習慣(食事・睡眠等)が安定している方 |
| 募集期限 | 2019年12月09日 |
【医療機器モニター】通院1回のみ!顔写真撮影の臨床研究モニター
| 問い合わせ番号 | 4668 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 顔にニキビやアトピーの皮疹、しみ、そばかす、ほくろが多く認められる方対象の画像診断アプリの開発を目的とした臨床試験モニターです。 【実施予定期間】2019年1月~2020年2月 |
| ご協力いただける方 | 性別不問。13歳から35歳までの方 ・顔面部に約1メートル離れた距離からでも認識可能な以下のいずれかの所見が1つ以上認められる方 ①ニキビが20個以上 ②ニキビ以外の炎症性の皮疹や紅斑(アトピー、脂漏性皮膚炎など)が10個以上 ③色素性病変(しみ、そばかす、ほくろ)が10個以上 |
| 募集期限 | 2020年01月26日 |
【サプリメントモニター】女性の方限定、サプリメントモニター試験(関東)
| 問い合わせ番号 | 4672 |
|---|---|
| 実施地区 | |
| 説明 | 月経痛の自覚がある方対象のサプリメントモニターのご案内です。 月経の諸症状の改善が期待されるサプリメントを8週間摂取していただいた際の効果を確認するモニターです。 参加開始時期:2019年7月 参加期間:6ヵ月間 内容:約2ヵ月間健康食品を摂取いただき、アンケートと日誌をWeb上で入力いただきます。 |
| ご協力いただける方 | 同意取得時に25歳以上40歳未満の女性 ・日本国籍をお持ちの日本人(ハーフ、クォーターは不可) ・スマートフォンをお持ちでWEB生活日誌に入力ができる方 ・直近6回分の月経周期が25~38日の範囲内であって、普段の月経持続日数が3~7日間である方 ・月経開始の3日位前から月経3日目頃にかけて月経随伴症状を有する方 |
| 募集期限 | 2019年09月20日 |
【サプリメントモニター】通院不要のサプリメントモニター(関東)
| 問い合わせ番号 | 4673 |
|---|---|
| 実施地区 | |
| 説明 | 便通、疲労、睡眠などでお困りの方を対象に、改善が期待されるサプリメントを4週間摂取していただいた際の効果を確認するモニターです。 ご自宅に郵送されたサプリメントを毎日1日3回摂取していただき、スマホアプリから毎日簡単なアンケートにご回答いただく通院不要のモニターとなります。 普段忙しくて通院タイプのモニターにご参加できない方にもオススメです。 参加開始時期:2019年6月 参加期間:4ヵ月間 内容:アプリにて、生活日誌とアンケート入力のみ(通院なし) |
| ご協力いただける方 | ・年齢:20歳~64歳 ・日本国籍をお持ちの日本人(ハーフ、クォーターは不可) ・携帯アプリを使用するのでスマートフォンをお持ちの方で、生活日誌が入力できる方 ・関東近郊(茨城、栃木、群馬、山梨、東京、神奈川、千葉、埼玉)に在住の方 ・睡眠、便通、疲労のうち、最低一つ以上の悩みがある方 |
| 募集期限 | 2019年08月08日 |
【健康食品モニター】お腹の調子が悪い方対象の健康食品モニター試験(関東)
| 問い合わせ番号 | 4670 |
|---|---|
| 実施地区 | |
| 説明 | 「日頃からお腹の調子が悪い方を対象」にお腹の調子を整える健康食品モニター試験です。 参加開始時期:2019年5月 参加期間:2ヵ月 内容:1泊2日×2 |
| ご協力いただける方 | ・関東在住の方 ・試験参加同意取得時の年齢が20歳以上65歳未満の方 ・お腹の調子に悩んでいる方 ・来院予定日に指定の施設に来院・入院できる方 ・本試験の目的・内容について十分に理解した上で、書面による同意を得た方 |
| 募集期限 | 2019年08月01日 |
【緑内障】未治療もしくは2剤までで治療中の方対象(関西)
| 問い合わせ番号 | 4101 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 日本人の失明原因の第1位は緑内障です。 緑内障を放置すると、気が付かないうちに視野欠損が進行し、 はっきりと自覚できる状態になった時には、手遅れになることも。。。 詳細はこちら 緑内障の治療をやめて放置してしまっている方、 新しい薬に興味のある方、是非ご応募下さい。 参加開始時期:2017年8月 参加期間:約16週間 内容:2週間または4週間おきに通院を7回していただきます。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)で以下のいずれかに当てはまる方 ①未治療の状態で眼圧値が左右いずれかの眼で21mmHg以上の方 ②緑内障の治療中止4週間後の眼圧値が左右いずれかの眼で21mmHg以上が予想される方 ※眼圧の数値が不明な方も本治験にご興味のある方はお問い合わせください。 |
| 募集期限 | 2018年02月27日 |
【眼圧高値の方】眼圧が高いと指摘されている方(関西)
| 問い合わせ番号 | 4100 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | 日本人の失明原因の第1位は緑内障です。 そしてその緑内障の発症リスク要因の1つが眼圧高値です。 眼圧高値を放置すると、気が付かないうちに緑内障が発症、進行し、 自覚症状(視野欠損)が現れた時には、手遅れになることも。。。 詳細はこちら 眼圧高値を指摘されているのに放置している方、 治療をやめて放置してしまっている方、是非ご応募下さい。 参加開始時期:2017年8月 参加期間:約12週間 内容:2週間おきに通院を7回していただきます。 |
| ご協力いただける方 | 年齢20歳以上(男女不問)で以下のいずれかに当てはまる方 ①左右いずれかの眼で眼圧が21mmHg以上 ※過去に眼圧高値を指摘された事がある方もまずはお問い合わせください。 |
| 募集期限 | 2018年02月27日 |
【腹圧性尿失禁】くしゃみをした時、急に立ち上がった時の尿漏れが気になる方
| 問い合わせ番号 | 3962 |
|---|---|
| 実施地区 | 大阪 |
| 説明 | くしゃみをした時、階段を昇り降りしている時、急に立ち上がった時、重い荷物を持ち上げた時などに尿漏れを経験したことはございませんか? よく認められる方は、腹圧性尿失禁かもしれません。40歳以上の女性の3人に1人が何らかの尿トラブルを抱えているといわれております。 開始時期 実施中 参加期間:約4ヵ月間(14~16週間) 通院内容:2週間ごとに7回通院していただきます。 |
| ご協力いただける方 | 年齢20歳以上80歳未満の女性の方で 12週間以上継続して一定の基準以上の尿漏れの自覚がある方 |
| 募集期限 | 2017年05月31日 |






 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
||||
 |
 |